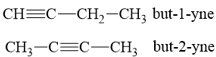Với lời giải SBT Hóa học 11 trang 68 chi tiết trong Ôn tập chương 4 trang 67 sách Chân trời sáng tạo giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Ôn tập chương 4 trang 67
Bài OT4.7 trang 68 SBT Hóa học 11: Khi đốt cháy 1 mol propane toả ra lượng nhiệt là 2 220 kJ. Để đun nóng 1 gam nước tăng thêm 1 °C cần cung cấp nhiệt lượng là 4,2 J. Tính khối lượng propane cần dùng để đun 1 L nước từ 25°C lên 100 °C. Cho biết 75% nhiệt lượng toả ra khi đốt cháy propane dùng để nâng nhiệt độ của nước. Khối lượng riêng của nước là 1 g/mL.
Lời giải:
Khối lượng của 1 L nước:
Nhiệt lượng cần cung cấp để đun 1 L nước từ 25°C lên 100 °C:
Số mol của propane cần dùng để đun 1 L nước từ 25°C lên 100 °C:
Khối lượng propane cần dùng để đun 1 L nước từ 25°C lên 100 °C (với hiệu suất đốt cháy propane là 75%):
Bài OT4.8 trang 68 SBT Hóa học 11: Cục Quản Lí Thực Phẩm và Dược Phẩm Hoa Kì (FDA) đã công nhận ethylene là an toàn trong việc kích thích trái cây mau chín. Tuy nhiên khi vượt quá nồng độ cho phép, ví dụ đối với nồng độ 27 000 ppm, tức gấp khoảng 200 lần mức cần thiết để kích thích quá trình chín, một tia lửa điện có thể đốt cháy ethylene và gây ra vụ nổ chết người.
Trong phòng ủ chín, ethylene được sử dụng ở nồng độ 100 ppm – 150 ppm. Khối lượng ethylene cần thiết sử dụng để phòng ủ chín có thể tích 50 m3 đạt nồng độ 140 ppm ở 25 °C và 1 bar là bao nhiêu?
Lời giải:
Thể tích của ethylene cần sử dụng trong phòng ủ chín có thể tích 50 m3 đạt nồng độ 140 ppm:
Số mol của ethylene cần sử dụng trong phòng ủ chín có thể tích 50 m3 đạt nồng độ 140 ppm:
Khối lượng của ethylene cần sử dụng trong phòng ủ chín có thể tích 50 m3 đạt nồng độ 140 ppm:
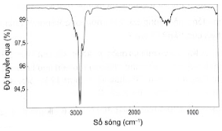
Bài OT4.9 trang 68 SBT Hóa học 11: (A) và (B) là 2 alkyne đồng phân có cùng công thức phân tử C4H6. Phân tích phổ hồng ngoại của (A) được kết quả sau:
Gọi tên các alkyne (A) và (B) theo danh pháp thay thế.
Lời giải:
Alkyne C4H6 có 2 đồng phân:
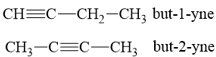
Đặc trưng phổ hồng ngoại của các alk-1-yne là có peak khoảng 3300 cm-1 do đó phổ hồng ngoại của alkyne (A) cho thấy (A) là but-2-yne và (B) là but-1-yne.
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài OT4.1 trang 67 SBT Hóa học 11: Alkane (A) có công thức phân tử C8H18. (A) tác dụng với chlorine đun nóng chỉ tạo một dẫn xuất monochloro duy nhất. Tên gọi của (A) là...
Bài OT4.2 trang 67 SBT Hóa học 11: Cho các alkene sau: CH2=CH-CH3; (CH3)2C=C(CH3)2; CH3CH=CHCH3 và CH3CH=CHC2H5. Số alkene có đồng phân hình học là....
Bài OT4.3 trang 67 SBT Hóa học 11: Arene (B) có công thức phân tử C8H8. Khi có mặt bột sắt, (B) tác dụng với bromine tạo một sản phẩm thế monobromo duy nhất. Số công thức cấu tạo phù hợp với (B) là...
Bài OT4.4 trang 67 SBT Hóa học 11: Hoá lỏng một alkane ở thể khí là cách để tối ưu hoá khả năng lưu trữ alkane trong các thiết bị. Để hoá lỏng một alkane ở thể khí, người ta có thể tiến hành trong điều kiện nhiệt độ thấp hơn nhiệt độ sôi của alkane. Ví dụ chúng ta có thể hoá lỏng propane ở nhiệt độ thấp hơn −42 °C hay methane xuống thấp hơn nhiệt độ –162 °C.....
Bài OT4.5 trang 67 SBT Hóa học 11: Ở các nước Mỹ, Úc và một số quốc gia khác, khí hoá lỏng (LPG – Liquefied Petroleum Gas) được sử dụng nhiều làm nhiên liệu là propane hoá lỏng, Em hãy tính xem một bình khí hoá lỏng chứa 12 kg propane có thể cung cấp bao nhiêu lít khí propane ở 25 °C, 1 bar.....
Bài OT4.6 trang 67 SBT Hóa học 11: Quan sát biểu đồ thể hiện nhiệt độ sôi của 6 alkane đầu tiên....
Bài OT4.7 trang 68 SBT Hóa học 11: Khi đốt cháy 1 mol propane toả ra lượng nhiệt là 2 220 kJ. Để đun nóng 1 gam nước tăng thêm 1 °C cần cung cấp nhiệt lượng là 4,2 J. Tính khối lượng propane cần dùng để đun 1 L nước từ 25°C lên 100 °C. Cho biết 75% nhiệt lượng toả ra khi đốt cháy propane dùng để nâng nhiệt độ của nước. Khối lượng riêng của nước là 1 g/mL....
Bài OT4.8 trang 68 SBT Hóa học 11: Cục Quản Lí Thực Phẩm và Dược Phẩm Hoa Kì (FDA) đã công nhận ethylene là an toàn trong việc kích thích trái cây mau chín. Tuy nhiên khi vượt quá nồng độ cho phép, ví dụ đối với nồng độ 27 000 ppm, tức gấp khoảng 200 lần mức cần thiết để kích thích quá trình chín, một tia lửa điện có thể đốt cháy ethylene và gây ra vụ nổ chết người.....
Bài OT4.9 trang 68 SBT Hóa học 11: (A) và (B) là 2 alkyne đồng phân có cùng công thức phân tử C4H6. Phân tích phổ hồng ngoại của (A) được kết quả sau:....
Bài OT4.10 trang 69 SBT Hóa học 11: Gọi tên các hợp chất sau theo danh pháp thay tth....
Bài OT4.11 trang 69 SBT Hóa học 11: a) Gọi tên hydrocarbon sau theo danh pháp thay thế:...
Bài OT4.12 trang 69 SBT Hóa học 11: (H) và (K) là 2 hydrocarbon có cùng công thức phân tử C10H14 và đều không làm mất màu nước bromine, nhưng cả hai chất này đều làm mất màu dung dịch thuốc tím đã được acid hoá (ví dụ dung dịch KMnO4 trong H2SO4), trong đó (H) tạo terephthalic acid là sản phẩm hữu cơ duy nhất, (K) tạo 2 sản phẩm hữu cơ là terephthalic acid và chất (X). Xác định công thức cấu tạo của (H), (K), (X) và viết các phương trình phản ứng xảy ra.....
Bài OT4.13* trang 69 SBT Hóa học 11: So sánh điều kiện và khả năng phản ứng thế bromine vào vòng benzene của toluene với anisole (C6H5OCH3). Giải thích....
Bài OT4.14* trang 69 SBT Hóa học 11: Giải thích tại sao m-xylene tham gia phản ứng nitro hoá nhanh hơn p-xylene 100 lần.....
Xem thêm các bài giải SBT Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác: