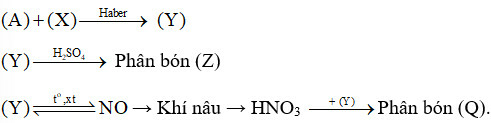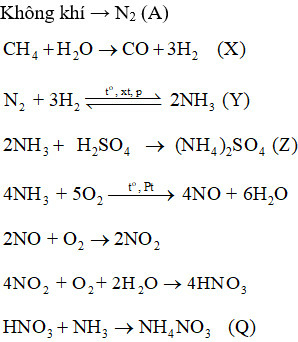Với lời giải SBT Hóa học 11 trang 32 chi tiết trong Ôn tập chương 2 trang 31 sách Chân trời sáng tạo giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Ôn tập chương 2 trang 31
Bài OT2.6 trang 32 SBT Hóa học 11: Hãy xếp các nội dung sau cho hợp lí trong quá trình hình thành sắp hiện tượng phú dưỡng:
(A) Sự phân huỷ xác động thực vật bởi vi khuẩn sử dụng nhiều oxygen trong nước gây nên tình trạng thiếu oxygen nghiêm trọng, làm chết cả hệ sinh thái.
(B) Ánh sáng mặt trời bị cản trở làm ảnh hưởng đến quá trình quang hợp. gây thiếu oxygen làm cho thực vật và động vật chết.
(C) Chất dinh dưỡng giúp thực vật và tảo sống trong nước phát triển ồ ạt.
(D) Phân bón và chất dinh dưỡng bị rửa trôi xuống sông, ao, hồ, ...
Lời giải:
Quá trình hình thành sắp hiện tượng phú dưỡng: (D), (C), (B), (A).
Bài OT2.7 trang 32 SBT Hóa học 11: Nguyên tắc vận tải bằng đường xe lửa đối với sulfuric acid đặc chứa trong các toa thùng yêu cầu nghiêm ngặt rằng phải đóng kín ngay tức khắc vòi thoát sau khi tháo acid ra khỏi toa thùng. Hãy giải thích điều này.
Lời giải:
Sulfuric acid đặc ở nhiệt độ thường không tác dụng với Fe (do Fe bị thụ động hoá bởi H2SO4 đặc nguội) nên có thể chuyên chở được trong các toa thùng bằng thép. Khi vòi thoát không được đóng kín ngay, sulfuric acid đặc hấp thụ hơi nước trong không khí rất mạnh và trở thành acid loãng sẽ ăn mòn thành toa thùng rất nhanh.
Bài OT2.8 trang 32 SBT Hóa học 11: Sơ đồ quy trình dưới đây mô tả các bước trong quá trình sản xuất một số loại phân bón. Hãy xác định các chất (A), (X), (Y), (Z), (Q). Viết các phản ứng hoá học xảy ra.
Không khí → (A)
Methane → (X)
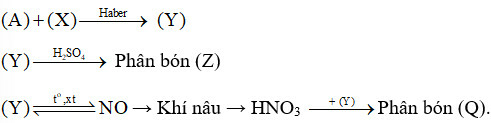
Lời giải:
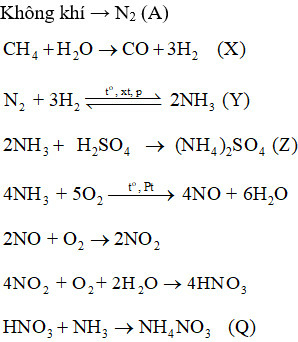
Bài OT2.9* trang 32 SBT Hóa học 11: Đặt hai cốc (A), (B) có khối lượng bằng nhau lên 2 đĩa cân, cân ở vị trí thăng bằng. Cho 120 gam hỗn hợp potassium hydrogencarbonate và sodium hydrogencarbonate vào cốc (A); 85 gam silver nitrate vào cốc (B). Thêm từ từ 100 gam dung dịch sulfuric acid 19,6% vào cốc (A); 100 gam dung dịch hydrochloric acid 36,5% vào cốc (B). Sau thí nghiệm, cân có ở vị trí thăng bằng không? Nếu cân không ở vị trí thăng bằng thì cần thêm bao nhiêu gam dung dịch hydrochloric acid 36,5% vào cốc nào để cân trở lại vị trí thăng bằng? Giả thiết khí CO2 không tan trong nước, bỏ qua quá trình bay hơi của nước và hydrogen chloride.
Lời giải:
- Xét cốc (A): Đặt công thức chung của KHCO3 và NaHCO3 là RHCO3.
Ta có:
Đặt số mol của RHCO3 là x (1,2 < x < 1,4).
Ta có: 2RHCO3 + H2SO4 → R2SO4 + 2H2O + 2CO2
Vì nên RHCO3 dư, H2SO4 hết.
- Xét cốc (B): AgNO3 + HCl → AgCl + HNO3
Nước và hydrogen chloride không bay hơi
Để cân bằng, ta cần thêm dung dịch hydrochloric acid 36,5% vào cốc (B).
Khối lượng dung dịch hydrochloric acid 36,5% cho vào cốc (B):
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài OT2.1 trang 31 SBT Hóa học 11: Điều nào sau đây đúng về tính chất hoá học của N2?...
Bài OT2.2 trang 31 SBT Hóa học 11: Điều nào sau đây đúng về tính chất hoá học của NH3?...
Bài OT2.3 trang 31 SBT Hóa học 11: Điều nào sau đây không đúng về tính chất hoá học của dung dịch HNO3?...
Bài OT2.4 trang 31 SBT Hóa học 11: Phát biểu nào diễn tả đúng tính chất hoá học của SO2?...
Bài OT2.5 trang 31 SBT Hóa học 11: Điều nào sau đây đúng về tính chất hoá học của dung dịch H2SO4 đặc?...
Bài OT2.6 trang 32 SBT Hóa học 11: Hãy xếp các nội dung sau cho hợp lí trong quá trình hình thành sắp hiện tượng phú dưỡng:...
Bài OT2.7 trang 32 SBT Hóa học 11: Nguyên tắc vận tải bằng đường xe lửa đối với sulfuric acid đặc chứa trong các toa thùng yêu cầu nghiêm ngặt rằng phải đóng kín ngay tức khắc vòi thoát sau khi tháo acid ra khỏi toa thùng. Hãy giải thích điều này...
Bài OT2.8 trang 32 SBT Hóa học 11: Sơ đồ quy trình dưới đây mô tả các bước trong quá trình sản xuất một số loại phân bón. Hãy xác định các chất (A), (X), (Y), (Z), (Q). Viết các phản ứng hoá học xảy ra...
Bài OT2.9* trang 32 SBT Hóa học 11: Đặt hai cốc (A), (B) có khối lượng bằng nhau lên 2 đĩa cân, cân ở vị trí thăng bằng. Cho 120 gam hỗn hợp potassium hydrogencarbonate và sodium hydrogencarbonate vào cốc (A); 85 gam silver nitrate vào cốc (B). Thêm từ từ 100 gam dung dịch sulfuric acid 19,6% vào cốc (A); 100 gam dung dịch hydrochloric acid 36,5% vào cốc (B). Sau thí nghiệm, cân có ở vị trí thăng bằng không? Nếu cân không ở vị trí thăng bằng thì cần thêm bao nhiêu gam dung dịch hydrochloric acid 36,5% vào cốc nào để cân trở lại vị trí thăng bằng? Giả thiết khí CO2 không tan trong nước, bỏ qua quá trình bay hơi của nước và hydrogen chloride...
Xem thêm các bài giải SBT Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 7: Sulfuric acid và muối sulfate
Ôn tập chương 2