Với giải sách bài tập Hoá học 10 Bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học sách Chân trời sáng tạo hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 10. Mời các bạn đón xem:
Giải SBT Hoá học lớp 10 Bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Bài 7.1 trang 24 SBT Hóa học 10: Cấu hình electron nguyên tử iron: (Ar)3d64s2. Iron ở
A. ô 26, chu kì 4, nhóm VIIIA.
B. ô 26, chu kì 4, nhóm VIIIB.
C. ô 26, chu kì 4, nhóm IIA.
D. ô 26, chu kì 4, nhóm IIB.
Lời giải:
Đáp án đúng là: B
Iron ở ô 26 do (Z = 26); chu kì 4 (do có 4 lớp electron); nhóm VIIIB (do nguyên tố d, 8 electron hóa trị).
Bài 7.2 trang 24 SBT Hóa học 10: Nguyên tố X có số hiệu nguyên tử là 8
a. Nguyên tử của nguyên tố X có cấu hình electron là
A.
B.
C.
D.
b. Nguyên tố X thuộc chu kì
A. 1
B. 2
C. 3
D. 4
c. Nguyên tố X thuộc nhóm
A. VIIIB
B. VIB
C. VIIA
D. VIA
Lời giải:
a) Đáp án đúng là: D
Z = 8, cấu hình electron: 1s22s22p4.
b) Đáp án đúng là: B
X thuộc chu kì 2 do nguyên tử có 2 lớp electron.
c) Đáp án đúng là: D
X thuộc nhóm VIA do nguyên tố p, 6 electron hóa trị.
A.
B.
C.
D.
Lời giải:
Đáp án đúng là: D
X thuộc chu kì 3, nhóm IIA nên có 3 lớp electron, lớp ngoài cùng có 2 electron.
Cấu hình electron của X là:
Bài 7.4 trang 24 SBT Hóa học 10: Nguyên tử của nguyên tố X có cấu hình electron:
a. Số electron lớp ngoài cùng của X là
A. 3
B. 2
C. 6
D. 5
b. X thuộc chu kì
A. 1
B. 2
C. 3
D. 4
c. X thuộc nhóm
A. IA
B. VA
C. IIIA
D. IVA
Lời giải:
a) Đáp án đúng là: D
X có 5 electron ở lớp ngoài cùng.
b) Đáp án đúng là: C
X thuộc chu kì 3 do có 3 lớp electron.
c) Đáp án đúng là: B
X thuộc nhóm VA do nguyên tố p, 5 electron hóa trị.
- Cấu hình electron của phosphorus.
- Số electron lớp ngoài cùng của nguyên tử phosphorus.
- Phosphorus là kim loại hay phi kim
- Công thức oxide cao nhất của phosphorus
- Công thức hợp chất khí của phosphorus với hydrogen
- Công thức hydroxide cao nhất của phosphorus
- Oxide và hydroxide cao nhất của phosphorus có tính acid hay base.
Lời giải:
- Cấu hình electron của phosphorus: 1s22s22p63s23p3.
- Số electron lớp ngoài cùng của nguyên tử phosphorus: 5.
- Phosphorus là phi kim.
- Công thức oxide cao nhất của phosphorus: P2O5.
- Công thức hợp chất khí của phosphorus với hydrogen: PH3.
- Công thức hydroxide cao nhất của phosphorus: H3PO4.
- Oxide và hydroxide cao nhất của phosphorus có tính acid.
a. Tính nguyên tử khối của X.
b. X là nguyên tố nào?
Lời giải:
a) Hợp chất khí với hydrogen của nguyên tố X có công thức XH4. Oxide cao nhất của X là XO2. Gọi X là nguyên tử khối của X, theo bài ra ta có:
Vậy nguyên tử khối của X là 28.
b) X thuộc nhóm IVA, nguyên tử khối là 28. X là silicon (Si).
Lời giải:
Hợp chất với hydrogen là RH3 nên oxide cao nhất có công thức R2O5.
Gọi R là nguyên tử khối của R. Ta có:
Vậy R là nitrogen (N).
Lời giải:
Nguyên tố R thuộc nhóm VIA nên oxide cao nhất có dạng RO3.
Ta có:
Vậy R là sulfur (S), công thức oxide cao nhất là SO3.
Lời giải:
Oxide cao nhất của nguyên tố R có dạng R2O5 nên R thuộc nhóm VA.
Hợp chất với hydrogen là RH3.
Theo bài ra, ta có:
Vậy R là phosphorus (P), công thức hợp chất với hydrogen là PH3.
Lời giải:
Hợp chất với hydrogen có công thức là RHx.
Hợp chất oxide cao nhất có công thức là R2O8 – x.
Oxide cao nhất của nguyên tố R chứa 72,73% oxygen nên:
Hợp chất khí với hydrogen chứa 75% nguyên tố R nên:
Thay (2) vào (1) được x = 4 ⇒ R = 12, vậy R là carbon (C).
Oxide cao nhất của R là CO2 và hợp chất khí với hydrogen là CH4.
Bài giảng Hóa học 10 Bài 7: Định luật tuần hoàn – ý nghĩa của bảng tuần hoàn các nguyên tố hóa học - Chân trời sáng tạo
Xem thêm các bài giải SBT Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Lý thuyết Định luật tuần hoàn – ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
I. Định luật tuần hoàn
- Sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố cũng như hợp chất của chúng.
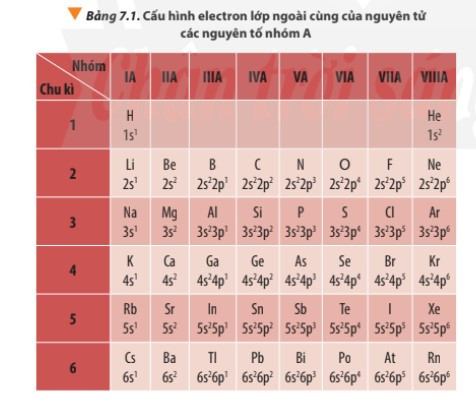
- Định luật tuần hoàn: Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
II. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
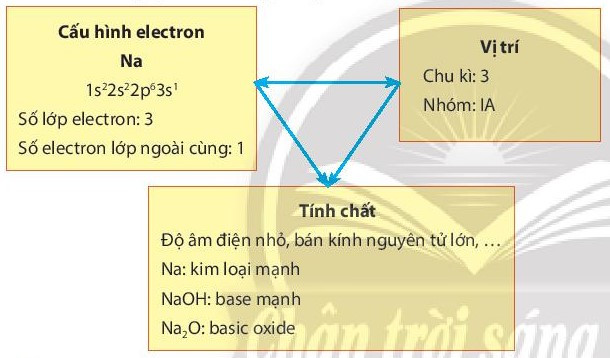
- Khi biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra cấu tạo nguyên tử của nguyên tố đó và ngược lại. Từ đó có thể suy ra những tính chất hóa học cơ bản của nó.
Ví dụ: Mối quan hệ giữa vị trí, cấu hình electron và tính chất của sodium: