Với giải sách bài tập Hoá học 10 Ôn tập chương 2 sách Chân trời sáng tạo hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 10. Mời các bạn đón xem:
Giải SBT Hoá học lớp 10 Ôn tập chương 2
Giải SBT Hoá học 10 trang 26
Bài OT 2.1 trang 26 SBT Hóa học 10: Sắt (iron) là vật liệu dùng làm bộ khung cho các công trình xây dựng, các khung giàn cho các loại cầu vượt, cầu bắc qua sông, cầu đi bộ, … Nguyên tố sắt nằm ở ô 26 trong bảng tuần hoàn. Cấu hình electron của nguyên tử iron là:
A.
B.
C.
D.
Lời giải:
Đáp án đúng là: A
Fe (Z = 26), cấu hình electron:
Bài OT 2.2 trang 26 SBT Hóa học 10: Các muối của nguyên tố chromium được dùng trong ngành thuộc da, làm phụ gia cho xăng, chất nhuộm màu xanh lục hay màu hồng ngọc cho đồ gốm, trang thiết bị trong dàn khoan, thuốc nhuộm, sơn và chất vệ sinh cho đồ dùng thủy tinh trong phòng thí nghiệm. Nguyên tử nguyên tố Cr có cấu hình . Vị trí của nguyên tố Cr trong bảng tuần hoàn:
A. ô 24, chu kì 3, nhóm IA.
B. ô 24, chu kì 4, nhóm VIB
C. ô 24, chu kì 4, nhóm VIA
D. ô 24, chu kì 4, nhóm IB
Lời giải:
Đáp án đúng là: B
Cr ở ô 24 (do Z = 24), chu kì 4 (do có 4 lớp electron), nhóm VIB (do nguyên tố d, 6 electron hóa trị).
Bài OT 2.3 trang 26 SBT Hóa học 10: Dãy các nguyên tố nào sau đây sắp xếp theo chiều tăng dần độ âm điện của nguyên tử?
A. C, F, Ca, O, Be
B. Ca, Be, C, O, F
C. F, O, C, Be, Ca
D. O, C, F, Ca, Be
Lời giải:
Đáp án đúng là: B
F có độ âm điện lớn nhất nên xếp cuối cùng → A, C, D sai.
Bài OT 2.4 trang 26 SBT Hóa học 10: Dãy các nguyên tố nào sau đây sắp xếp theo chiều tăng dần bán kính nguyên tử?
A. C, F, Ca, O, Be
B. Ca, Be, C, O, F
C. F, O, C, Be, Ca
D. O, C, F, Ca, Be
Lời giải:
Đáp án đúng là: C
F, O, C, Be thuộc cùng chu kì 2, theo quy luật biến đổi có bán kính nguyên tử:
F < O < C < Be (1)
Be và Ca thuộc cùng nhóm IIA, theo quy luật biến đổi có bán kính nguyên tử:
Be < Ca (2)
Từ (1) và (2) có bán kính nguyên tử: F < O < C < Be < Ca.
Giải SBT Hoá học 10 trang 27
Bài OT 2.5 trang 27 SBT Hóa học 10: Silicon được dùng trong công nghệ sản xuất chip máy tính hiện đại. Aluminium được dùng để làm vỏ phủ vệ tinh nhân tạo hay khí cầu nhằm tăng nhiệt độ nhờ nó có tính hấp thụ bức xạ điện từ Mặt Trời khá tốt. Phosphorus là một khoáng chất thiết yếu đối với sự phát triển của xương và răng. Hãy so sánh tính phi kim của Si, Al và P.
Lời giải:
Si, Al và P cùng thuộc chu kì 3.

Theo quy luật biến đổi tính chất có tính phi kim tăng dần theo dãy: Al, Si, P.
Bài OT 2.6 trang 27 SBT Hóa học 10: Sodium hydroxide được ứng dụng trong khâu loại bỏ acid béo để tinh chế dầu thực vật, động vật trước khi dùng để sản xuất thực phẩm. Magnesium hydroxide là một thành phần phổ biến của các thuốc kháng acid cũng như các thuốc nhuận tràng. Aluminium hydroxide được dùng trong sản xuất gốm sứ, thủy tinh và sản xuất giấy. So sánh tính base của NaOH, Mg(OH)2, Al(OH)3.
Lời giải:
Ta có Na, Mg, Al thuộc cùng chu kì 3.

Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần.
Vậy tính base giảm dần theo dãy: NaOH, Mg(OH)2, Al(OH)3.
Bài OT 2.7 trang 27 SBT Hóa học 10: Oxide cao nhất của một nguyên tố là RO3. Nó có trong thành phần của oleum, được sử dụng trong sản xuất nhiều chất nổ. Trong hợp chất khí của R với hydrogen có 5,88% hydrogen về khối lượng. Xác định nguyên tố R.
Lời giải:
Oxide cao nhất của nguyên tố R là RO3. Công thức hợp chất khí với hydrogen của R là RH2. Trong hợp chất khí của R với hydrogen có 5,88% hydrogen về khối lượng nên:
Vậy R là sulfur (S), oxide cao nhất của R là SO3.
Bài OT 2.8 trang 27 SBT Hóa học 10: Hợp chất khí với hydrogen của nguyên tố R là RH4. Oxide cao nhất của R chứa 53,3% oxygen về khối lượng. Oxide này được sử dụng trong ngành xây dựng, như sản xuất bê tông. Tìm nguyên tố R.
Lời giải:
Hợp chất khí với hydrogen của nguyên tố R là RH4. Oxide cao nhất của R là RO2.
Oxide cao nhất của R chứa 53,3% oxygen về khối lượng nên:
Nguyên tố R là silicon (Si).
Bài OT 2.9 trang 27 SBT Hóa học 10: Trong sản xuất thịt chế biến sẵn, người ta thường bổ sung một hợp chất có công thức dạng X2Y để ức chế sự sinh sôi phát triển của vi khuẩn trong thịt, giúp thịt lâu hư, tránh các trường hợp ngộ độc thực phẩm do thịt bị ôi thiu. Phân tử X2Y có tổng số proton là 23. Biết X, Y ở hai nhóm A liên tiếp trong cùng một chu kì. Tìm công thức phân tử của X2Y.
Lời giải:
Gọi số proton của X và Y là ZX và ZY.
Trường hợp 1: X đứng trước Y, ta có hệ phương trình:
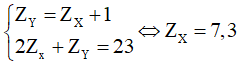
Trường hợp 1 không thỏa mãn.
Trường hợp 2: Y đứng trước X, ta có hệ phương trình:
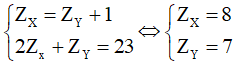
Vậy X là oxygen (O); Y là nitrogen (N); công thức phân tử cần tìm là NO2.
Bài OT 2.10 trang 27 SBT Hóa học 10: Có hai nguyên tố X, Y thuộc cùng nhóm và ở hai chu kì liên tiếp, tổng số đơn vị điện tích hạt nhân của X và Y là 58. Trong đó, một nguyên tố đóng vai trò quan trọng đối với hệ thần kinh, đặc biệt ở người già thiếu chất này dễ bị suy nhược thần kinh, trí nhớ kém, tinh thần không ổn định, đau đầu. Oxide của nguyên tố còn lại nhờ tính ổn định nhiệt cao nên được ứng dụng nhiều trong ngành công nghệ gốm sứ, thủy tinh và quang học. Xác định X, Y.
Lời giải:
Gọi số hiệu nguyên tử X và Y lần lượt là ZX và ZY. Ta có: ZX + ZY = 58 (1)
Giả sử X đứng trước Y do đó ZX < ZY.
Do X và Y thuộc cùng một nhóm và ở hai chu kì liên tiếp, do đó X và Y có thể cách nhau 8, 18 hoặc 32 nguyên tố.
Trường hợp 1: ZY = ZX + 8, thay vào (1) được ZX = 25 suy ra ZY = 33.
X có cấu hình electron: 1s22s22p63s23p63d54s2 (thuộc nhóm VIIB)
Y có cấu hình electron: [Ar] 3d¹⁰4s²4p3 (thuộc nhóm VA)
Vậy trường hợp 1 không thỏa mãn.
Trường hợp 2: ZY = ZX + 18, thay vào (1) được ZX = 20 suy ra ZY = 38.
X có cấu hình electron: 1s22s22p63s23p64s2 (chu kì 4, nhóm IIA)
Y có cấu hình electron: [Kr] 5s2 (chu kì 5, nhóm IIA)
Vậy trường hợp 2 thỏa mãn, X là calcium và Y là strontium.
Trường hợp 3: ZY = ZX + 32, thay vào (1) được ZX = 13 suy ra ZY = 45.
X có cấu hình electron: 1s22s22p63s23p1 (nhóm IIIA)
Y có cấu hình electron: [Kr] 4d85s1 (nhóm VIIIB)
Vậy trường hợp 3 không thỏa mãn.
Xem thêm các bài giải SBT Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Ôn tập chương 2
Bài 8: Quy tắc octet
Bài 9: Liên kết ion
Bài 10: Liên kết cộng hóa trị