Khí hiđro là chất khí không màu, không mùi, không vị, tan rất ít trong nước và nhẹ nhất trong tất cả các khí. Qua bài bài viết sau đây, các em sẽ nắm được cách nhận biết khí H2 và biết thêm về ứng dụng của khí hiđro
Cách nhận biết khí H2
I. Cách nhận biết khí H2
Đặc điểm: Khí hiđro không tan trong nước và không phản ứng với dung dịch axit hay bazơ hay muối.
- Cách nhận biết: Cho đi qua CuO, đun nóng.
- Hiện tượng: Chất rắn màu đen chuyển dần sang màu đỏ
- Phương trình hóa học:
CuO + H2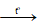 Cu↓+ H2O
Cu↓+ H2O
Ngoài ra: Khí H2 cháy trong không khí cho ngọn lửa có màu xanh nhạt và tỏa nhiều nhiệt.
2H2 + O2 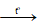 2H2O
2H2O
II. Mở rộng
Khí hiđro có nhiều ứng dụng trong đời sống và sản xuất như:
- Làm nhiên liệu cho động cơ tên lửa, nhiên liệu động cơ thay thế xăng.
- Hàn cắt kim loại với đèn xì oxi – hiđro.
- Là nguyên liệu để sản xuất amoniac (NH3), axit clohiđric (HCl) và nhiều hợp chất hữu cơ.
- Dùng bơm cho khinh khí cầu.
- Dùng làm chất khử để điều chế kim loại từ những oxit của chúng.
III. Bài tập nhận biết khí H2
Bài 1: Nêu phương pháp nhận biết các khí sau: H2, O2, CO2?
Hướng dẫn giải:
- Dẫn các khí đi qua CuO, đun nóng:
+ Chất rắn chuyển từ màu đen sang màu đỏ: H2
H2 + CuO 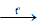 Cu↓ + H2O
Cu↓ + H2O
+ Không hiện tượng: O2 và CO2
- Sục hai khí còn lại qua dung dịch nước vôi trong, hiện tượng;
+ Dung dịch vẩn đục: CO2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
+ Không hiện tượng: O2.
Bài 2: Nêu phương pháp tách khí H2 bị lẫn tạp chất khí H2S?
Hướng dẫn giải:
- Dẫn hỗn hợp khí qua dung dịch NaOH dư, khí H2S phản ứng bị giữ lại, bay thoát ra ngoài là khí H2.
- Phương trình hóa học:
H2S + 2NaOHdư → Na2S + H2O
Xem thêm cách nhận biết các chất hóa học nhanh, chi tiết khác:
Cách nhận biết khí hiđro clorua (HCl)
Cách nhận biết khí metylamin, etylamin, đimetylamin, trimetylamin