Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Chuyên đề sử dụng phương pháp đồ thị ôn thi THPTQG môn Hóa học , tài liệu bao gồm 42 trang, giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi môn Hóa sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây
TÀI LIỆU ÔN THI THPT QUỐC GIA
CHUYÊN ĐỀ SỬ DỤNG PHƯƠNG PHÁP ĐỒ THỊ
I. Phương pháp giải chung
Cách giải chung của phương pháp đồ thị gồm 4 bước sau:
Xác định dáng của đồ thị.
Xác định tọa độ các điểm quan trọng (thường là 3 điểm gồm: xuất phát, cực đại và cực tiểu)
Xác định tỉ lệ trong đồ thị (tỉ lệ trong đồ thị chính là tỉ lệ trong phản ứng).
Từ đồ thị đã cho và giả thiết để trả lời các yêu cầu của bài toán.
II. Một số dạng bài sử dụng phương pháp đồ thị
Dạng 1: XO2 tác dụng với dung dịch M(OH)2
a. Bài tập sử dụng phương pháp đồ thị đơn thuần
b. Bài tập sử dụng phương pháp đồ thị kết hợp công thức giải nhanh
Dạng 2: XO2 tác dụng với dung dịch gồm MOH& M(OH)2
a. Bài tập sử dụng phương pháp đồ thị đơn thuần
b. Bài tập sử dụng phương pháp đồ thị kết hợp công thức giải nhanh
Dạng 3: OH- tác dụng với dung dịch chứa H+, Al3+
a. Bài tập sử dụng phương pháp đồ thị đơn thuần
b. Bài tập sử dụng phương pháp đồ thị kết hợp công thức giải nhanh
Dạng 4: OH-tác dụng với H+ và Zn2+
III. Bài tập cho số liệu ở dạng đồ thị trong Đề thi thử THPT QG
Dạng 1: XO2 tác dụng với dung dịch M(OH)2
A. Bài tập sử dụng đồ thị đơn thuần
I. Thiết lập hình dáng của đồ thị.
+ Khi sục CO2 vào dung dịch chứa a mol Ca(OH)2 thì đầu tiên xảy ra pư
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Suy ra:
Lượng kết tủa tăng dần
Số mol kết tủa luôn bằng số mol CO2.
Số mol kết tủa max = a (mol)
Đồ thị của pư trên là:
+ Khi lượng CO2 bắt đầu dư thì lượng kết tủa tan ra theo pư:
CaCO3 + CO2 + H2O → Ca(HCO3)2
Suy ra:
Lượng kết tủa giảm dần đến 0 (mol)
Đồ thị đi xuống một cách đối xứng
II. Phương pháp giải
Dáng của đồ thị: Hình chữ V ngược đối xứng
Tọa độ các điểm quan trọng
+ Điểm xuất phát: (0,0)
+ Điểm cực đại(kết tủa cực đại): (a, a)[a là số mol của Ca(OH)2] kết tủa cực đại là a mol.
+ Điểm cực tiểu: (0, 2a)
Tỉ lệ trong đồ thị: 1:1
III. Bài tập minh họa
Bài 1: Sục từ từ đến dư CO2 vào dung dịch Ca(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị
như hình bên. Giá trị của a và b là
A. 0,2 và 0,4. B. 0,2 và 0,5. C. 0,2 và 0,3. D. 0,3 và 0,4.
Hướng dẫn:
+ Từ tỉ lệ của đồ thị bài toán a = 0,2 mol.
+ Tương tự ta cũng có b = 2a = 0,4 mol
+ Vậy chọn đáp án A
Bài 2: Hấp thụ hết V lít CO2 ở đktc vào 4 lít dung dịch Ca(OH)2 0,05 M thu được 15 gam kết tủa. Giá
trị của V là
A. 4,48 lít hoặc 5,6 lít. B. 3,36 lít. C. 4,48 lít. D. 3,36 lít hoặc 5,60 lít.
Hướng dẫn:
+ Theo giả thiết ta có: Ca(OH)2 = 0,2 mol CaCO3 max = 0,2 mol
Điểm cực tiểu là: (0; 0,4)
+ Vì CaCO3 = 0,15 mol nên ta có đồ thị:
+ Từ đồ thị x = 0,15 mol và 0,4 - y = 0,15 mol y = 0,25 mol V = 3,36 hoặc 5,6 lít.
Bài 3: Cho 20 lít hỗn hợp khí A gồm N2 và CO2 ở đktc vào 2 lít dung dịch Ca(OH)2 0,2 M thì thu
được 10 gam kết tủa. Phần trăm thể tích của CO2 trong hỗn hợp A là
A. 11,2% hoặc 78,4%. B. 11,2%.
C. 22,4% hoặc 78,4%. D. 11,2% hoặc 22,4%.
Hướng dẫn:
+ Theo giả thiết ta có: Ca(OH)2 = 0,4 mol CaCO3 max = 0,4 mol
+ Vì CaCO3 = 0,1 mol nên ta có đồ thị:
+ Từ đồ thị x = 0,1 và 0,8 - y = 0,1 y = 0,7 %VCO2 bằng 11,2% hoặc 78,4%
Bài 4: Hấp thụ hoàn toàn 26,88 lít CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 a mol/l thu được 157,6
gam kết tủa. Giá trị của a là
A. 0,4 mol/l. B. 0,3 mol/l. C. 0,5 mol/l. D. 0,6 mol/l.
Hướng dẫn:
+ Ta có: CO2 = 1,2 mol; BaCO3 = 0,8 mol; Ba(OH)2 = 2,5a mol.
+ Đồ thị của bài toán:
+ Do đồ thị đối xứng nên ta có: 2,5a – 0,8 = 1,2 – 2,5a a = 0,4.
Bài 5: Trong 1 bình kín chứa 0,2 mol Ba(OH)2. Sục vào bình lượng CO2 có giá trị biến thiên trong
khoảng từ 0,05 mol đến 0,24 mol thu được m gam kết tủa. Giá trị của m biến thiên trong khoảng
nào sau đây?
A. 0 đến 39,4 gam. B. 0 đến 9,85 gam. C. 9,85 đến 39,4 gam. D. 9,85 đến 31,52 gam.
Hướng dẫn:
+ Theo giả thiết ta có đồ thị:
+ Từ đồ thị x = 0,05 mol và y = 0,4 – 0,24 = 0,16 mol
+ Nhưng kết tủa phải biến thiên trong khoảng: 9,85 gam đến cực đại là 39,4 g
Bài 6: Sục từ từ 0,6 mol CO2 vào V lít dung dịch chứa Ba(OH)2 0,5M thu được 2x mol kết tủa. Mặt
khác khi sục 0,8 mol CO2 cũng vào V lít dung dịch chứa Ba(OH)2 0,5M thì thu được x mol kết tủa. Giá
trị của V, x lần lượt là
A. V = 1,0 lít; x = 0,2 mol. B. V = 1,2 lít; x = 0,3 mol.
C. V = 1,5 lít; x = 0,5 mol. D. V = 1,0 lít; x = 0,4 mol.
Hướng dẫn:
+ Dễ thấy số mol CO2 tăng từ 0,6 → 0,8 thì lượng kết tủa giảm ứng với 0,8 mol CO2 sẽ có pư hòa
tan kết tủa.
+ TH1: Ứng với 0,6 mol có không có pư hòa tan kết tủa. Đồ thị như sau:
+ Từ đồ thị suy ra:
2x = 0,6 x = 0,3 (1).
x = V – 0,8 (2)
0,5V ≥ 0,6 (3)
+ Từ (1, 2, 3) không có nghiệm phù hợp.
+ TH2: Ứng với 0,6 mol có có pư hòa tan kết tủa. Đồ thị như sau:
Bài 7: Sục từ từ đến dư CO2 vào một cốc đựng dung dịch Ca(OH)2. KQ thí nghiệm được biểu diễn
trên đồ thị như hình bên. Khi lượng CO2 đã sục vào dung dịch là 0,85 mol thì lượng kết tủa đã xuất
hiện là m gam. Giá trị của m là
A. 40 gam. B. 55 gam. C. 45 gam. D. 35 gam.
Hướng dẫn:
+ Từ đồ thị (hình 1) a = 0,3 mol.
+ Dễ thấy kết tủa cực đại = 0,3 + (1 – 0,3): 2 = 0,65 mol.
+ Từ kết quả trên ta vẽ lại đồ thị:
Từ đồ thị này suy ra khi CO2 = 0,85 mol x = 1,3 – 0,85 = 0,45 mol
m = 45 gam.
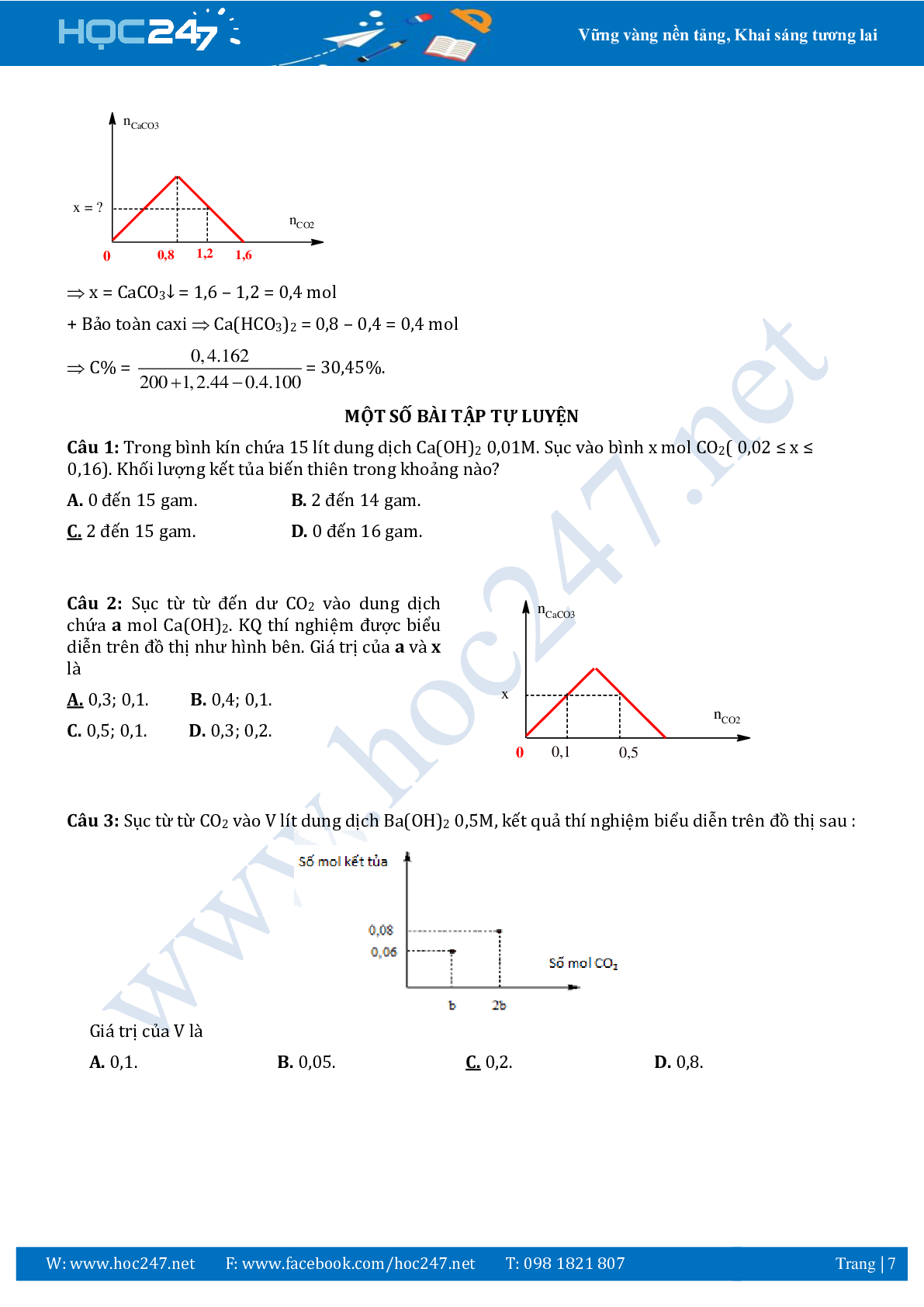
Bài 8: Sục CO2 vào 200 gam dung dịch Ca(OH)2 ta có kết quả theo đồ thị như hình bên. Tính C% của
chất tan trong dung dịch sau phản ứng?
A. 30,45% B. 40% C.40,45% D.50,45%
Hướng dẫn:
+ Ta có Ca(OH)2 = 0,8 mol.
+ CO2 = 1,2 mol .
+ Từ đồ thị
x = CaCO3↓ = 1,6 – 1,2 = 0,4 mol
+ Bảo toàn caxi Ca(HCO3)2 = 0,8 – 0,4 = 0,4 mol
MỘT SỐ BÀI TẬP TỰ LUYỆN
Câu 1: Trong bình kín chứa 15 lít dung dịch Ca(OH)2 0,01M. Sục vào bình x mol CO2( 0,02 ≤ x ≤
0,16). Khối lượng kết tủa biến thiên trong khoảng nào?
A. 0 đến 15 gam. B. 2 đến 14 gam.
C. 2 đến 15 gam. D. 0 đến 16 gam.
Câu 2: Sục từ từ đến dư CO2 vào dung dịch
chứa a mol Ca(OH)2. KQ thí nghiệm được biểu
diễn trên đồ thị như hình bên. Giá trị của a và x
là
A. 0,3; 0,1. B. 0,4; 0,1.
C. 0,5; 0,1. D. 0,3; 0,2.