Với tóm tắt lý thuyết Hóa học lớp 9 Luyện tập: Tính chất hóa học của oxit và axit hay, chi tiết cùng với 42 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 9.
Hóa học 9 Bài 5: Luyện tập: Tính chất hóa học của oxit và axit
A. Lý thuyết Luyện tập: Tính chất hóa học của oxit và axit
I. Sơ đồ thể hiện tính chất chung của oxit
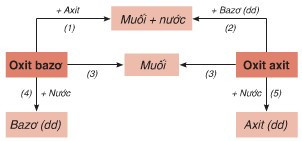
Phản ứng hóa học minh họa cho sơ đồ:
(1) CaO + 2HCl → CaCl2 + H2O
(2) CO2 + Ca(OH)2 → CaCO3↓ + H2O
(3) CaO + CO2 → CaCO3
(4) CaO + H2O → Ca(OH)2
(5) CO2 + H2O → H2CO3
II. Sơ đồ thể hiện tính chất chung của axit
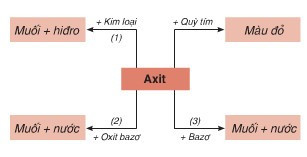
Phương trình hóa học minh họa cho sơ đồ:
(1) H2SO4 loãng + Fe → FeSO4 + H2
(2) H2SO4 + CuO → CuSO4 + H2O
(3) H2SO4 + 2NaOH → Na2SO4 + 2H2O
Chú ý: H2SO4 đặc có những tính chất hóa học riêng
- Tác dụng với nhiều kim loại không giải phóng H2. Ví dụ:
Cu + 2H2SO4 (đặc) CuSO4 + SO2 ↑ + 2H2O
2Fe + 6H2SO4 (đặc) Fe2(SO4)3 + 3SO2 ↑ + 6H2O
- Tính háo nước, hút ẩm. Ví dụ:
Khi cho axit H2SO4 đặc vào đường, đường sẽ hóa thành than.
C12H22O11 12C + 11H2O
Sau đó một phần C sinh ra lại bị H2SO4 đặc oxi hóa:
C + 2H2SO4 (đặc) → CO2 + 2SO2 + 2H2O

H2SO4 đặc tác dụng với đường.
B. Trắc nghiệm Luyện tập: Tính chất hóa học của oxit và axit
Bài 1: Cho 1,68 lít CO2 (đktc) sục vào bình đựng 250 ml dung dịch KOH dư. Biết thể tích dung dịch trước và sau phản ứng không thay đổi Nồng độ mol/lit của muối thu được sau phản ứng là
A. 0,2M B. 0,3M
C. 0,4M D. 0,5M
nCO2 = 0,075 mol
Vì KOH dư nên phản ứng tạo ra muối trung hòa
CO2 + 2KOH → K2CO3 + H2O
0,075 mol → 0,075 mol
Vì thể tích dung dịch trước và sau không thay đổi => Vdd = 250 ml = 0,25
lít
Đáp án cần chọn là: B
Bài 2: Dùng 400ml dung dịch Ba(OH)2 0,1M hấp thụ hoàn toàn V lít khí SO2 (đktc). Sau phản ứng thu được muối BaSO3 không tan. Giá trị bằng số của V là:
|
A. 0,896 lít |
B. 0,448 lít |
|
C. 8,960 lít |
D. 4,480 lít |
nBa(OH)2 = 0,04 mol
SO2 + Ba(OH)2 → BaSO3 + H2O
Tỉ lệ 1 1
Phản ứng ?mol 0,04 mol
Từ phương trình => nSO2= n Ba(OH)2 = 0,04 mol
=> VSO2 = nCO2 . 22,4 = 0,04 . 22,4 = 0,896 lít
Đáp án: A
Bài 3: Cho 11,2 lít CO2 vào 500 ml dung dịch NaOH 25% (D = 1,3 g/ml). Nồng độ mol/lit của dung dịch muối tạo thành là
A. 1M B. 2M
C. 2,5M D. 1,5M
nCO2 = 0,5 mol
+) Áp dụng công thức: mdd = D.V = 1,3.500 = 650 gam
=> nNaOH = 4,0625 mol
Xét tỉ lệ:
=> NaOH dư, CO2 hết, phản ứng thu được muối Na2CO3
CO2 + 2NaOH → Na2CO3 + H2O
0,5 mol → 0,5 mol
Đáp án: A
Câu 4: Khi pha loãng axit sunfuric người ta phải
A. đổ từ từ axit vào nước
B. đổ từ từ nước vào axit
C. đổ nhanh axit vào nước
D. đổ nhanh nước vào axit
H2SO4 tan vô hạn trong nước và tỏa rất nhiều nhiệt. Nếu ta rót nước vào H2SO4, nước sôi đột ngột và kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm. Vì vậy, muốn pha loãng axit H2SO4 đặc, người ta phải rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh và không được làm ngược lại
Đáp án: A
Câu 5: Khi pha loãng axit sunfuric từ axit đặc người ta phải:
A. đổ từ từ axit đặc vào nước
B. đổ từ từ nước vào axit đặc
C. đổ nhanh axit đặc vào nước
D. đổ nhanh nước vào axit đặc
Khi pha loãng axit sunfuric từ axit đặc người ta phải đổ từ từ axit đặc vào nước
Đáp án: A
Câu 6: Kim loại nào sau đây không tác dụng được với dung dịch axit HCl?
A. Al
B. Fe
C. Na
D. Cu
Al, Fe, Na đều tác dụng với dung dịch HCl
Cu không tác dụng với dung dịch HCl
Đáp án: D
Câu 7: Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là
A. Cu, Zn, Na.
B. Au, Pt, Cu.
C. Ag, Ba, Fe.
D. Mg, Fe, Zn.
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là Mg, Fe, Zn.
H2SO4 không phản ứng với Cu, Ag, Pt.
Đáp án: D
Câu 8: Dung dịch H2SO4 loãng phản ứng được với :
A. Au.
B. Fe.
C. Ag.
D. Cu.
Au, Ag, Cu là kim loại đứng sau H trong dãy điện hóa học nên không phản ứng được với dd H2SO4 loãng.
Đáp án: B
Câu 9: Để nhận biết dung dịch H2SO4, người ta thường dùng
A. dung dịch NaOH.
B. dung dịch KCl.
C. dung dịch BaCl2.
D. dung dịch CuSO4.
Để nhận biết dung dịch H2SO4, người ta thường dùng dung dịch BaCl2 vì tạo kết tủa trắng BaSO4
Đáp án: C
Câu 10: Hiện tượng khi thêm vài giọt dung dịch H2SO4 vào dung dịch BaCl2 là:
A. Xuất hiện kết tủa hồng.
B. Xuất hiện kết tủa trắng.
C. Xuất hiện kết tủa xanh lam.
D. Xuất hiện kết tủa nâu đỏ.
Hiện tượng: xuất hiện kết tủa trắng
H2SO4 + BaCl2 → BaSO4↓ trắng + 2HCl
Đáp án: B
Câu 11: Để nhận biết axit sunfuric và muối sunfat người ta thường dùng
A. BaCl2
B. Ba3(PO4)2
C. BaCO3
D. BaSO4
Để nhận biết axit sunfuric và muối sunfat, ta dùng dung dịch muối BaCl2, Ba(NO3)2 hoặc Ba(OH)2 vì tạo kết tủa trắng
Đáp án: A
Câu 12: Nhỏ từ từ dung dịch BaCl2 vào dung dịch Na2SO4 ta thấy xuất hiện
A. Xuất hiện kết tủa màu trắng
B. Xuất hiện kết tủa màu xanh lam
C. Có bọt khí thoát ra khỏi dung dịch
D. Chất kết tủa màu đỏ
Nhỏ từ từ dung dịch BaCl2 vào dung dịch Na2SO4 ta thấy xuất hiện kết tủa màu trắng
Do BaCl2 + Na2SO4 → BaSO4(↓ trắng) + 2NaCl
Đáp án: A
Câu 13: Hoà tan hết 25,2 gam kim loại R trong dung dịch axit HCl, sau phản ứng thu được 10,08 lít H2 (đktc). Kim loại R là
A. Fe
B. Zn
C. Mg
D. Al
| a | 1 | 2 | 3 | 4 |
| R | 28 (loại) | 56 (Fe) | 84 (loại) | 112 (loại) |
Vậy kim loại cần tìm là sắt (Fe)
Đáp án: A
Câu 14: Hoà tan hoàn toàn 6,5 gam một kim loại A chưa rõ hoá trị vào dung dịch axit H2SO4, thì thu được 2,24 lít H2 (đktc). Kim loại A là
A. Zn
B. Fe
C. Mg
D. Al
| a | 1 | 2 | 3 | 4 |
| A | 32,5 (loại) | 65 (Zn) | 97,5 (loại) | 130 (loại) |
Kim loại A là Zn
Đáp án: A
Câu 15: Hóa chất có thể dùng để nhận bết 2 axit HCl và H2SO4 ?
A. NaOH
B. Ba(OH)2
C. Fe
D. CaO
Hóa chất có thể dùng để nhận bết 2 axit HCl và H2SO4: Ba(OH)2
Đáp án: B
Câu 16: Cho hỗn hợp X gồm Al và Ag phản ứng với dung dịch axit H2SO4 thu được 5,6 lít H2 (đktc). Sau phản ứng còn 3 gam một chất rắn không tan. Thành phần phần trăm theo khối lượng của Ag trong hỗn hợp X ban đầu là
A. 30%.
B. 50%.
C. 40%.
D. 60%.
Đáp án: C
Câu 17: Để hoà tan vừa hết 4,48 gam Fe phải dùng bao nhiêu ml dung dịch hỗn hợp HCl 0,5M và H2SO4 0,75M?
A. 100 ml.
B. 80 ml.
C. 90 ml.
D. 120 ml.
nFe = 0,08 mol
Gọi thể tích dung dịch hỗn hợp axit cần dùng là V (lít)
⇒ nHCl = 0,5V mol; nH2SO4 = 0,75V mol
Fe + 2HCl → FeCl2 + H2
0,25V ← 0,5V
Fe + H2SO4 → FeSO4 + H2
0,75V ← 0,75V
⇒ nFe = 0,25V + 0,75V = 0,08 ⇒ V = 0,08 lít = 80 ml
Đáp án: B
Câu 18: Hòa tan 50,54 gam hỗn hợp X gồm (Fe, Al) trong dung dịch H2SO4 loãng dư thu được V lít khí H2 (đktc) và dung dịch A, cô cạn dung dịch A thu được 178,22 gam hỗn hợp muối. Giá trị của V là
A. 30,240.
B. 29,568.
C. 29,792.
D. 27,328.
Đáp án: C
Câu 19: Cho 10,5 gam hỗn hợp hai kim loại Zn, Cu vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
A. 61,9% và 38,1%
B. 63% và 37%
C. 61,5% và 38,5%
D. 65% và 35%
Đáp án: A
Câu 20: Hòa tan hoàn toàn hỗn hợp (Fe, Mg) bằng dung dịch HCl 20% (vừa đủ) thu được dung dịch A. Trong dung dịch A nồng độ của MgCl2 = 11,787%. Tính C% của FeCl2 trong dung dịch A
A. 22,22%.
B. 14,45%.
C. 24,13%.
D. 15,76%.
Đáp án: D
Câu 21: Cho 0,1mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
A. 13,6 g
B. 1,36 g
C. 20,4 g
D. 27,2 g
Đáp án: A
Câu 22: Hoà tan 12,1 g hỗn hợp bột kim loại Zn và Fe cần 400ml dung dịch HCl 1M. Khối lượng hỗn hợp muối thu được sau phản ứng là:
A. 26,3 g
B. 40,5 g
C. 19,2 g
D. 22,8 g
Đáp án: A
Câu 23: Cho 69,75 gam hỗn hợp A gồm CaCO3 và Na2CO3 tác dụng vừa đủ với 337,5 gam dung dịch HCl 14,6% thu được dung dịch X và V lit CO2 (đktc). Giá trị của V là
A. 15,12.
B. 8,40.
C. 6,72.
D. 8,96.
Gọi số mol của CaCO3 và Na2CO3 lần lượt là x và y mol
Đáp án: A
Câu 24: Cho 2,44 gam hỗn hợp muối Na2CO3 và K2CO3 tác dụng vừa đủ với dung dịch H2SO4 0,5M, sau phản ứng thu được 0,448 lít CO2 ở đktc. Thể tích dung dịch H2SO4 0,5 M cần dùng là:
A. 100 ml
B. 40ml
C. 30 ml
D. 25 ml
Đặt x,y lần lượt là số mol của Na2CO3 và (x,y>0)
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O (1)
x mol x mol x mol x mol
K2CO3 + H2SO4 → K2SO4 + CO2 + H2O (2)
y mol y mol y mol y mol
Từ phương trình ta dễ thấy muối cacbonat tác dụng với H2SO4 thì
Đáp án: A
Câu 25: Cho 50,9 gam hỗn hợp rắn A gồm BaCl2 và BaCO3 tác dụng vừa đủ với dung dịch H2SO4 thu được V lít CO2 (đktc), 58,25 gam kết tủa và dung dịch X. Giá trị của V là
A. 3,36.
B. 4,48.
C. 2,24.
D. 1,12.
Đáp án: C
Câu 26: Cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M. Thể tích dung dịch HCl đã dùng là:
A. 2,5 lít
B. 0,25 lít
C. 3,5 lít
D. 1,5 lít
Đáp án: B
Câu 27: Hoà tan 2,84 gam hỗn hợp 2 muối CaCO3 và MgCO3 bằng dung dịch HCl dư thu được 0,672 lít khí CO2 (đktc). Thành phần % số mol mỗi muối trong hỗn hợp lần lượt là:
A. 50% và 50%
B. 33% và 67%
C. 75% và 25%
D. 67% và 33%
Gọi x là thành phần % số mol của CaCO3 trong hỗn hợp thì (1 - x) là thành phần % số mol của MgCO3.
Ta có
Đáp án: D
Câu 28: Cho các dãy chất dưới đây, dãy chất nào tác dụng được với dung dịch axit sunfuric loãng?
A. CuO, Cu, K2O, CO.
B. SO2, CuO, Fe, CO2.
C. KOH, CuO, Fe, BaCl2.
D. CuO, CO2, MgO, K2O.
A. Loại Cu và CO không phản ứng
B. Loại CO2 không phản ứng
C. Thỏa mãn
D. Loại CO2 không phản ứng
Đáp án: C
Câu 29: Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là:
A. Fe, Cu, Mg.
B. Zn, Fe, Cu.
C. Zn, Fe, Al.
D. Fe, Zn, Ag
Các kim loại đứng trước H2 mới phản ứng được với H2SO4 loãng
A, B loại vì Cu đứng sau H2
D loại vì Ag đứng sau H2
Đáp án: C
Câu 30: Dung dịch HCl không tác dụng với chất nào sau đây?
A. CuO.
B. Ag.
C. NaOH.
D. AgNO3.
Ag là kim loại đứng sau H trong dãy điện hóa nên không tác dụng được với HCl
Đáp án: B
Câu 31: Nhóm chất tác dụng với nước và với dung dịch HCl là:
A. Na2O, SO3, CO2 .
B. K2O, P2O5, CaO.
C. BaO, SO3, P2O5.
D. CaO, BaO, Na2O.
Dễ thấy các đáp án đều là các oxit, oxit phản ứng với nước và dung dịch HCl thì oxit đó là oxit bazo
A loại vì SO3 và CO2 là oxit axit
B loại vì có P2O5 là oxit axit
C loại vì có SO3 và P2O5 là oxit axit
Đáp án: D
Câu 32: Trong công nghiệp, sản xuất axitsunfuric qua mấy công đoạn
A. 1
B. 2
C. 3
D. 4
Sản xuất axit sunfuric gồm 3 giai đoạn:
Giai đoạn 1: Đốt lưu huỳnh cháy trong không khí
Giai đoạn 2: sản xuất SO3 bằng cách oxi hóa SO2
Giai đoạn 3: Cho SO3 tác dụng với nước để điều chế H2SO4
SO3 + H2O → H2SO4
Đáp án: C
Câu 33: Công thức hóa học của axit sunfuric là:
A. HCl.
B. H2SO3.
C. H2SO4.
D. HClO.
CTHH của axit sunfuric là: H2SO4
Đáp án: C
Câu 34: Axit clohiđric có công thức hóa học là:
A. H2SO4
B. HCl
C. H3PO4
D. H2CO3
Axit clohiđric có công thức hóa học là: HCl
Đáp án: B
Câu 35: Dung dịch axit loãng H2SO4 khi phản ứng với chất nào dưới đây mà khí H2 không giải phóng ra (không được sinh ra)?
A. Fe
B. Cu.
C. Mg.
D. Al
Cu là kim loại đứng sau H trong dãy điện hóa nên không phản ứng được với dd H2SO4 loãng, do vậy không sinh ra được khí H2
Đáp án: B
Câu 36: Dãy các chất không tác dụng được với dung dịch H2SO4 loãng là:
A. Zn, ZnO, Zn(OH)2.
B. Cu, CuO, Cu(OH)2.
C. Na2O, NaOH, Na2CO3.
D. MgO, MgCO3, Mg(OH)2.
Oxit bazo, bazo và một số muối tác dụng được với dung dịch H2SO4 loãng
=> Đáp án: B vì có Cu đứng sau H2 không tác dụng được với H2SO4
Đáp án: B
Câu 37: Khi cho kim loại Fe tác dụng với axit H2SO4 đặc, nóng, dư không tạo thành sản phẩm nào trong các sản phẩm sau đây?
A. FeSO4
B. H2O
C. SO2
D. Fe2(SO4)
Đáp án: A
Câu 38: Sự khác biệt trong tính chất hóa học của H2SO4 đặc so với H2SO4 loãng là
A. tác dụng được với oxit bazơ
B. tác dụng được với bazơ
C. tác dụng được với kim loại
D. khả năng hút nước mạnh (tính háo nước)
Axit sunfuric đặc có những tính chất hóa học riêng so với H2SO4 loãng
+ tác dụng với hầu hết kim loại (trừ Au và Pt)
+ tính háo nước
Đáp án: D
Câu 39: Để phân biệt 2 dung dịch HCl và H2SO4 loãng. Ta dùng kim loại
A. Mg
B. Ba
C. Cu
D. Zn
H2SO4 tác dụng với Ba xuất hiện khí và kết tủa trắng còn HCl chỉ xuất hiện khí
PTHH: Ba + H2SO4 → BaSO4↓ + H2↑
Ba + 2HCl → BaCl2 + H2↑
Đáp án: B
Câu 40: Thuốc thử dùng để nhận biết dung dịch HCl và dung dịch H2SO4 là:
A. K2SO4
B. Ba(OH)2
C. NaCl
D. NaNO3
HCl phản ứng với Ba(OH)2 không có hiện tượng còn H2SO4 xuất hiện kết tủa trắng
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Đáp án: B
Câu 41: Hiện tượng khi cho vài giọt axit H2SO4 đặc vào cốc nghiệm chứa 1 ít đường là:
A. Không xảy ra hiện tượng gì
B. Đường bị hóa đen, cột chất rắn dâng cao, có khói trắng thoát ra
C. Đường tan trong axit tạo dung dịch trong suốt, không có bọt khí thoát ra
D. Đường tan trong axit tạo dung dịch trong suốt, có bọt khí thoát ra.
Khi cho vài giọt axit H2SO4 đặc vào cốc nghiệm chứa 1 ít đường thì đường bị hóa đen, cột chất rắn dâng cao, có khói trắng thoát ra
Đáp án: B
Câu 42: Khả năng tan của H2SO4 trong nước là
A. rất ít
B. ít
C. bình thường
D. nhiều
Axit sunfuric là chất lỏng sánh, không màu, nặng gấp đôi nước, không bay hơi, dễ tan trong nước, tỏa rất nhiều nhiệt.
Đáp án: D