Với tóm tắt lý thuyết Hóa học lớp 8 Tính theo phương trình hóa học hay, chi tiết cùng với 30 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 8.
Hóa học 8 Bài 22: Tính theo phương trình hóa học
A. Lý thuyết Tính theo phương trình hóa học
1. Tìm khối lượng chất tham gia và chất sản phẩm
Cách làm:
- Bước 1: Viết phương trình
- Bước 2: tính số mol các chất
- Bước 3: dựa vào phương trình tính được số mol chất cần tìm
- Bước 4: tính khối lượng
Thí dụ 1: cho 4g NaOH tác dụng với CuSO4 tạo ra Cu(OH)2 kết tủa và Na2SO4. Tính khối lượng Na2SO4
Các bước tiến hành
- Viết PTHH và cân bằng
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
Tính số mol NaOH tham gia phản ứng
nNaOH = 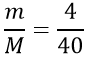
Tính số mol Na2SO4 thu được
Theo PTHH: 1 mol NaOH phản ứng thu được 0,5 mol Na2SO4
Vậy: 0,1 mol NaOH…………………0,05 mol Na2SO4
Tìm khối lương Na2SO4 thu được
mNa2SO4 = n×M = 0,05×142 = 7,1g
Thí dụ 2: Tính khối lương NaOH cần dùng để điều chế 7,1g Na2SO4
Viết PTHH:
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
Tính số mol Na2SO4 sinh ra sau phản ứng
nNa2SO4 = 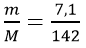
Tìm số mol NaOH tham gia phản ứng
Theo PTHH: để điều chế 1 mol Na2SO4 cần dùng 2 mol NaOH
Vậy muốn điều chế 0,05 mol Na2SO4 cần dùng 0,1 mol NaOH
Tính khối lương NaOH cần dùng
mNaOH = n×M = 0,1×40 = 4(g)
2. Tìm thể tích chất khí tham gia và sản phẩm
Cách làm:
- Bước 1: Viết PTHH
- Bước 2: Tìm số mol khí
- Bước 3: thông qua PTHH, tìm số mol chất cần tính
- Bước 4: Tìm thể tích khí
Thí dụ 1: Lưu huỳnh cháy trong oxi hoặc trong không khí sinh ra lưu huỳnh đioxit SO2. Hãy tính thể tích (đktc) sinh ra, nếu có 4g khí O2 tham gia phản ứng
- Viết PTHH
S + O2 −to→ SO2
- Tìm số mol O2 sinh ra sau phản ứng:
nO2 = 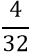
- Tìm số mol SO2 sinh ra sau phản ứng
Theo PTHH: 1 mol O2 tham gia phản ứng sinh ra 1 mol SO2
Vậy : 0,125 mol O2 …………………………. 0,125 mol SO2
- Tìm thể tích khí SO2(đktc) sinh ra sau phản ứng
VSO2 = n.22,4 = 0,125.2,24 = 2,8 lít
Thí dụ 2: tìm thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 64g lưu huỳnh
- Viết PTHH:
S + O2 −to→ SO2
- Tính số mol lưu huỳnh tham gia phản ứng
nS = 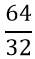
- Tính số mol O2 tham gia phản ứng
Theo PTHH: đốt cháy 1 mol S cần dùng 1 mol O2
Vậy : đốt cháy 2 mol S cần 2 mol O2
- Tính thể tích O2 cần dùng:
VO2 = 22,4 × n = 44,8 (l)
B. Trắc nghiệm Tính theo phương trình hóa học
Câu 1: Để đốt cháy hoàn toàn a gam Al cần dùng hết 19,2 gam oxi. Phản ứng kết thúc thu được sản phẩm là Al2O3. Giá trị của a là
A. 21,6
B. 16,2
C. 18,0
D. 27,0
Lời giải:
nO2 = 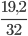 = 0,6 mol
= 0,6 mol
PTHH: 4Al + 3O2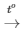 2Al2O3
2Al2O3
Tỉ lệ theo PT: 4mol 3mol
?mol 0,6mol
=> số mol Al phản ứng là: nAl = 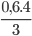 =0,8 mol
=0,8 mol
=> khối lượng Al phản ứng là: mAl = 0,8.27 = 21,6 gam
Đáp án cần chọn là: A
Câu 2: Lưu huỳnh S cháy trong không khí sinh ra chất khí mùi hắc, gây ho, đó là khí lưu huỳnh đioxit có công thức hóa học là SO2. Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6 gam. Tính khối lượng khí lưu huỳnh đioxit sinh ra.
A. 1,6 gam.
B. 3,2 gam.
C. 4,8 gam.
D. 6,4 gam.
Lời giải:
Số mol của S tham gia phản ứng: nS==0,05 mol
Phương trình hóa học của S cháy trong không khí:
S + O2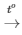 SO2
SO2
Tỉ lệ theo PT: 1mol 1mol
0,05mol ?mol
Theo phương trình hóa học, ta có: nSO2=nS= 05 mol
=> khối lượng khí lưu huỳnh đioxit sinh ra là
mSO2=n.M=0,05.64=3,2gam
Đáp án cần chọn là: B
Câu 3: Tính thể tích của oxi (đktc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
A. 1,4 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 2,8 lít.
Lời giải:
Số mol P phản ứng là: nP= 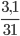 =0,1mol
=0,1mol
PTHH: 4P + 5O2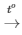 2P2O5
2P2O5
Tỉ lệ theo PT: 4mol 5mol
1mol ? mol
Nhân chéo chia ngang ta được: nO2= 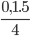 = 0,125
= 0,125
=> Thể tích oxi cần dùng là: V = 22,4.n = 22,4.0,125 = 2,8 lít
Đáp án cần chọn là: D
Câu 4: Đốt cháy hoàn toàn 1,12 lít khí CH4 (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được sản phẩm là khí cacbonic (CO2) và nước (H2O). Giá trị của V là
A. 2,24
B. 1,12
C. 3,36
D. 4,48
Lời giải:
Số mol khí CH4 phản ứng là: nCH4=1,1222,4=0,05molnCH4=1,1222,4=0,05mol
PTHH: CH4 + 2O2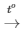 CO2 + 2H2O
CO2 + 2H2O
Tỉ lệ theo PT: 1mol 2mol 1mol 2mol
0,05mol ?mol
Từ PTHH, ta có: nO2= 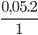 =0,1 mol
=0,1 mol
=> thể tích khí O2 cần dùng là: VO2=22,4.n=22,4.0,1=2,24 lít
Đáp án cần chọn là: A
Câu 5: Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO. Thể tích khí oxi đã dùng (đktc) là
A. 11,2 lít.
B. 3,36 lít.
C. 2,24 lít.
D. 4,48 lít.
Lời giải:
Số mol Zn là: nZn= 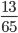 =0,2 mol
=0,2 mol
PTHH: 2Zn + O2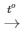 2ZnO
2ZnO
Tỉ lệ theo PT: 2mol 1mol 2mol
0,2mol ? mol
Số mol khí O2 đã dùng là: nO2= 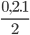 =0,1mol
=0,1mol
=> Thể tích O2 là: V = n.22,4 =0,1.22,4 = 2,24 lít
Đáp án cần chọn là: C
Câu 6: Đốt cháy hoàn toàn 27 gam Al trong oxi thu được Al2O3. Tính khối lượng Al2O3 thu được và thể tích oxi (đktc) đã dùng.
A. 51g và 16,8 lít
B. 51g và 33,6 lít
C. 51g và 22,4 lít
D. 102g và 16,8 lít
Lời giải:
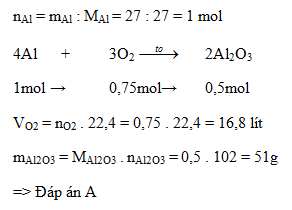
Đáp án cần chọn là: A
Câu 7: Cho PTHH :
Biết có 2,4.1022 nguyên tử Al phản ứng. Thể tích không khí cần dùng để đốt cháy hết lượng Al trên là: (Biết thể tích O2 chiếm 20% thể tích của không khí).
A. 0,672 lít
B. 3,36 lít
C. 4,48 lít
D. 0,896 lít
Lời giải:
nAl =2,4.1022 : 6: 1023 =0,04 mol
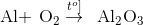 .
.
0,04 mol → 0,03 mol
→ VO2 = 0,03.22,4 =0,672 lít → V kk =0,672.5 =3,36 lít
Đáp án cần chọn là: B
Câu 8: Hãy tìm thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A. Biết rằng: – Khí A có tỉ lệ khối đối với không khí là 0,552 – Thành phần theo khối lượng của khí A là: 75% C và 25% H Các thể tích khí đo ở đktc
A. 11,2 lít.
B. 6,72 lít.
C. 22,4 lít.
D. 15,68 lít.
Lời giải:
Khối lượng mol khí A tham gia phản ứng là:
dA/kk = 0,552 => MA = 29 . 0,552 = 16 gam
mC = 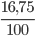 = 12 ; mH =
= 12 ; mH = 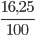 = 4
= 4
Đặt công thức hóa học của khí A là CxHy, ta có:
12 . x = 12 => x = 1
1 . y = 4 => y = 4
Công thức hóa học của khí A là CH4
Phương trình phản ứng : CH4 + 2O2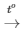 CO2 + 2H2O
CO2 + 2H2O
Theo phương trình phản ứng, thể tích oxi bằng hai lần thể tích khí CH4 nên thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A là:
VO2=2.VCH4VO2=2.VCH4 = 11,2 . 2 = 22,4 lít
Đáp án cần chọn là: C
Câu 9:
A,Biết rằng 2,3 gam một kim loại R (có hoá trị I) tác dụng vừa đủ với 1,12 lít khí clo (ở đktc) theo sơ đồ phản ứng:
R + Cl2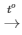 RCl
RCl
Kim loại R là:
A. K
B. Li
C. Cu
D. Na
Lời giải:
Số mol Cl2 cần dùng là: nCl2= 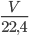 =
= 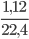 = 0,05 mol
= 0,05 mol
PTHH: 2R + Cl2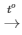 2RCl
2RCl
Tỉ lệ theo PT: 2mol 1mol 2 mol
?mol 0,05mol
Từ PTHH, ta có: nR=2.nCl2=2.0,05=0,1 mol
=> Khối lượng mol nguyên tử của R là:
MR= 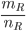 =
=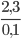 =23g/mol
=23g/mol
=> R là natri (Na)
Đáp án cần chọn là: D
B, Biết rằng 2,3 gam một kim loại R (có hoá trị I) tác dụng vừa đủ với 1,12 lít khí clo (ở đktc) theo sơ đồ phản ứng: R + Cl2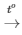 RCl
RCl
A. 5,85 gam.
B. 11,7 gam.
C. 7,02 gam.
D. 8,19 gam.
Cách 1:
PTHH: 2Na + Cl2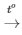 2NaCl
2NaCl
Theo pt: 2mol 1mol 2mol
0,05mol ?mol
Từ PTHH, ta có: nNaCl=2nCl2=2.0,05=0,1 mol
=> khối lượng của sản phẩm là: mNaCl = n.M = 0,1.58,5 = 5,85 gam
Cách 2: Theo định luật bảo toàn khối lượng:
mNaCl=mNa+mCl2 = 2,3+0,05.71=5,85 gam
Đáp án cần chọn là: A
Câu 10: Trong phòng thí nghiệm người ta có thể điều chế oxi bằng cách nhiệt phân kali clorat theo sơ đồ phản ứng: KClO3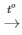 KCl + O2
KCl + O2
A. 24,5 gam.
B. 12,25 gam.
C. 36,75 gam.
D. 49,0 gam.
Lời giải:
Số mol O2 thu được là: nO2= 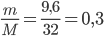
PTHH: 2KClO3 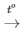 2KCl + 3O2
2KCl + 3O2
Tỉ lệ theo PT: 2 mol 2 mol 3 mol
?mol ?mol 0,3 mol
Từ PTHH, ta có: nKClO3=23. nO2=23.0,3=0,2 mol
=> Khối lượng của KClO3 cần dùng là:mKClO3= n . M = 0,2.122,5 = 24,5 gam
Đáp án cần chọn là: A
Câu 11: Cho phương trình hóa học sau: CaCO3 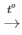 CaO + CO2
CaO + CO2
A. 0,1 mol.
B. 0,3 mol.
C. 0,2 mol.
D. 0,4 mol.
Lời giải:
Số mol CaO là : nCaO= 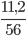 =0,2 mol
=0,2 mol
PTHH: CaCO3 to CaO + CO2
Tỉ lệ theo PT: 1mol 1mol
?mol 0,2mol
Từ PTHH, ta có: nCaCO3=nCaO=0,2 mol
Vậy cần dùng 0,2 mol CaCO3 để điều chế CaO
Đáp án cần chọn là: C
Câu 12: Khử 48 gam đồng (II) oxit bằng hiđro được 36,48 gam đồng sau phản ứng. Hiệu suất của phản ứng trên là:
A. 95%.
B. 90%.
C. 94%.
D. 85%.
Lời giải:
CuO + H2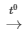 Cu + H2O
Cu + H2O
nCu = 36,48 /64 = 0,57 (mol)
nCuO = 48/ 80 = 0,6 (mol)
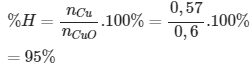
Đáp án cần chọn là: A
Câu 13: Cho 98 g H2SO4 loãng 20% phản ứng với thanh nhôm thấy có khí bay lên. Xác định thể tích khí đó
A. 4,8 l
B. 2,24 l
C. 4,48 l
D. 0,345 l
Đáp án: C
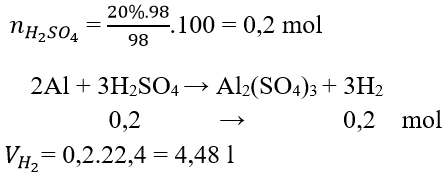
Câu 14: Cho 8,45 g Zn tác dụng với 5,376 l khí Clo (đktc). Hỏi chất nào sau phản ứng còn dư
A. Zn
B. Clo
C. Cả 2 chất
D. Không có chất dư
Đáp án: B
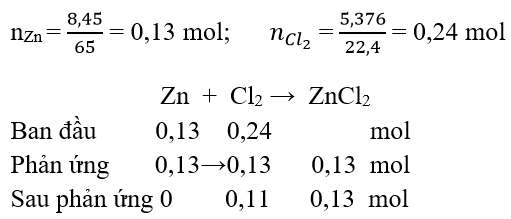
Câu 15: Nhiệt phân 2,45 g KClO3 thu được O2. Cho Zn tác dụng với O2 vừa thu được . Tính khối lượng chất thu được sau phản ứng
A. 2,45 g
B. 5,4 g
C. 4,86 g
D. 6,35 g
Đáp án: D
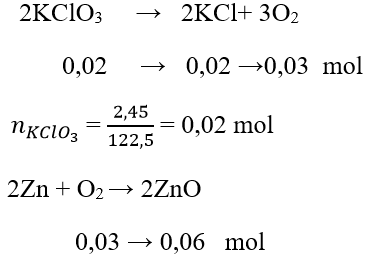
Sau phản ứng thu được KCl và ZnO
m = 0,06.81+ 0,02.74,5 = 6,35 g
Câu 16: Đốt cháy 11,2 l CH4 trong không khí thu được khí và nước. Xác định khí và cho biết số mol
A. CO và 0,5 mol
B. CO2 và 0,5 mol
C. C và 0,2 mol
D. CO2 và 0,054 mol
Đáp án: B
nCH4 = V/22,4 = 0,5 (mol)
CH4 + 2O2 → CO2 + 2H2O
0,5 → 0,5 mol
Câu 17: Nung 6,72 g Fe trong không khí thu được sắt (II) oxit. Tính mFeO và VO2
A. 1,344 g và 0,684 l
B. 2,688 l và 0,864 g
C. 1,344 l và 8,64 g
D. 8,64 g và 2,234 ml
Đáp án: C
2Fe + O2 → 2FeO
0,12→0,06→ 0,12 mol
mFeO = 0,12.72 = 8,64 g
VO2 = 0,06.22,4 = 1,344 l
Câu 18: Cho thanh magie cháy trong không khí thu được hợp chất magie oxit. Biết mMg = 7,2 g. Tính khối lượng hợp chất
A. 2,4 g
B. 9,6 g
C. 4,8 g
D. 12 g
Đáp án: C
nMg = 7,2/24 = 0,3 mol
2Mg + O2 → 2MgO
0,3 → 0,3 mol
mMgO = 0,3.40 = 4,8 g
Câu 19: Cho phương trình CaCO3 → CO2 + H2O
Để điều chế 2,24 l CO2 thì số mol CaCO3 cần dùng là
A. 1 mol
B. 0,1 mol
C. 0,001 mol
D. 2 mol
Đáp án: B
nCO2 = 2,24/22,4 = 0,1 mol
CaCO3 → CO2 + H2O
0,1 ← 0,1 (mol)
Câu 20: Ba + 2HCl → BaCl2 + H2
Để thu dược 4,16 g BaCl2 cần bao nhiêu mol HCl
A. 0,04 mol
B. 0,01 mol
C. 0,02 mol
D. 0,5 mol
Đáp án: A
nBaCl2 = 4,16/208 = 0,02 mol
Ba + 2HCl → BaCl2 + H2
0,04 ← 0,02 mol
Câu 21: Cho 5,6 g sắt tác dụng với dung dịch axit clohidric loãng thu được bao nhiêu ml khí H2
A. 2,24 ml
B. 22,4 ml
C. 2, 24.10-3 ml
D. 0,0224 ml
Đáp án: C
Fe + 2HCl → FeCl2 + H2
Nhìn vào phương trình thấy nFe = nH2 = 5,6/56 = 0,1 mol
VH2 = 0,1.22,4 = 2,24 l = 2,24.10-3 l
Câu 21: Cho 13,7 g Ba tác dụng với 3,2 g oxi thu được hợp chất oxit. Tính khối lượng oxi sau phản ứng
A. 3,2 g
B. 1,6 g
C. 6,4 g
D. 0,8 g
Đáp án: B

Khối lượng oxi sau phản ứng là m = 0,05.32 = 1,6 g