Với tóm tắt lý thuyết Hóa học lớp 8 Chuyển đổi giữa khối lượng, thể tích và lượng chất hay, chi tiết cùng với 34 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 8.
Hóa học 8 Bài 19: Chuyển đổi giữa khối lượng, thể tích và lượng chất
A. Lý thuyết Chuyển đổi giữa khối lượng, thể tích và lượng chất
1. Chuyển đối giữa lượng chất và khối lượng chất
m = n x M (g) ⇒
2. Chuyển đổi giữa lượng chất và thể tích khí
V = 22,4 x n (l) ⇒ n = 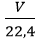
B. Trắc nghiệm Chuyển đổi giữa khối lượng, thể tích và lượng chất
Câu 1: Số mol phân tử N2 có trong 280 gam khí Nitơ là
A. 9 mol
B. 10 mol
C. 11 mol
D. 12 mol
Lời giải:
Khối lượng mol phân tử N2 là: 14.2 = 28 g/mol
=> số mol N2 là : n = 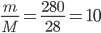
Đáp án cần chọn là: B
Câu 2: Khối lượng của 0,1 mol nhôm (Al) là:
A. 2,7 gam.
B. 5,4 gam.
C. 27 gam.
D. 54 gam.
Lời giải:
Khối lượng của 0,1 mol Al là: mAl = 0,1.27 = 2,7 (g)
Đáp án cần chọn là: A
Câu 3: Trong 24 gam MgO có bao nhiêu phân tử MgO?
A. 2,612.1023 phân tử
B. 3,612.1023 phân tử
C. 3,01.1023 phân tử
D. 4,2.1023 phân tử
Lời giải:
Khối lượng của MgO là: m = 24 g/mol
Khối lượng mol của MgO là: M = 24 + 16 = 40 gam
=> số mol MgO là: n= 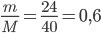 ( mol)
( mol)
=> số phân tử MgO là: 0,6.6,02.1023 = 3,612.1023 (phân tử)
Đáp án cần chọn là: B
Câu 4: Trong 7,2g FeO có bao nhiêu phân tử FeO?
A. 2,6.1023 phân tử
B. 0,6.1023 phân tử
C. 4,2.1023 phân tử
D. 6.1023 phân tử
Lời giải:
m FeO = 7,2 g; M FeO = 72 g/mol => nFeO = 0,1 mol
=> 1 mol FeO có chứa 6. 1023 phân tử FeO
vậy 0,1 mol FeO có chứa 0,6. 1023 phân tử FeO
Đáp án cần chọn là: B
Câu 5: Khối lượng nước mà trong đó có số phân tử bằng số phân tử có trong 20 gam NaOH là
A. 8 gam
B. 9 gam
C. 10 gam
D. 18 gam
Lời giải:
Khối lượng mol của NaOH là: M = 23 + 16 + 1 = 40 g/mol
=> số mol NaOH là: n= 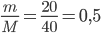 (mol)
(mol)
=> số mol của H2O là 0,5 mol
Khối lượng mol của H2O là: M = 2 + 16 = 18 g/mol
=> khối lượng nước là: m = n . M = 0,5.18 = 9 gam
Đáp án cần chọn là: B
Câu 6: Khối lượng của 0,1 mol khí H2S là:
A. 3,4 gam
B. 4,4 gam
C. 2,2 gam
D. 6,6 gam
Lời giải:
Khối lương của 0,1 mol khí H2S là: 0,1.34=3,4 g
Đáp án cần chọn là: A
Câu 7: Khối lượng của 0,01 mol khí SO2 là:
A. 3,3 gam
B. 0,35 gam
C. 6,4 gam
D. 0,64 gam
Lời giải:
Khối lương của 0,01 mol khí SO2 là: 0,01.64=0,64 g
Đáp án cần chọn là: D
Câu 8: Số mol nguyên tử hiđro có trong 36 gam nước là:
A. 1 mol
B. 1,5 mol
C. 2 mol
D. 4 mol
Lời giải:
Khối lượng của H2O là: 36 gam
Khối lượng mol của H2O : M = 2.1 + 16 = 18 g/mol
=> số mol của H2O là: n= 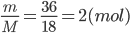
Trong 1 phân tử H2O có 2 nguyên tử H
=> trong 2 mol phân tử H2O có: 2.2 = 4 mol nguyên tử H
Đáp án cần chọn là: D
Câu 9: Tính số mol phân tử có trong 50 gam CaCO₃?
A. 1mol
B. 0,5mol
C. 1,2 mol
D. 1,5mol
Lời giải:
Đáp án cần chọn là: B
Câu 10: Khối lượng và thể tích (ở đktc) của CO2 có trong 0,5 mol khí CO2 là:
A. 22 gam và 11,2 lít
B. 22 gam và 1,12 lít
C. 11 gam và 11,2 lít
D. 11 gam và 1,12 lít
Lời giải:
mCO2 =0,5.44 =22g
VCO2 =0,5.22,4=11,2 lít
Đáp án cần chọn là: A
Câu 11: Phải lấy bao nhiêu gam sắt để có số nguyên tử nhiều gấp 2 lần số nguyên tử có trong 8 gam lưu huỳnh?
A. 29 gam
B.28,5 gam
C. 28 gam
D. 56 gam
Lời giải:
Khối lượng của S là: m = 8 gam
Khối lượng mol của S là: M = 32 g/mol
=> số mol của S là: 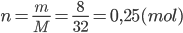
Vì số nguyên tử của sắt nhiều gấp 2 lần số nguyên tử S => số mol sắt nhiều gấp 2 lần số mol S
=> số mol sắt là: 0,25.2 = 0,5 mol
Khối lượng mol của sắt là M = 56 g/mol
=> khối lượng sắt cần lấy là: m = n. M = 0,5.56 = 28 gam
Đáp án cần chọn là: C
Câu 12: Thể tích của 280 gam khí nitơ ở đktc là:
+) Khí nitơ có công thức hóa học là N2
+) Tính khối lượng mol N2
+) 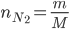
+) 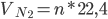
A. 112 lít
B. 336 lít
C. 168 lít
D. 224 lít
Lời giải:
Khối lượng mol của khí N2 là: M = 2.14 = 28 g/mol
=> số mol khí N2 là: n= 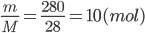
=> thể tích cảu 280 gam khí nitơ là: V = n.22,4 = 10.22,4 = 224 lít
Đáp án cần chọn là: D
Câu 13: Thể tích của 280g khí Nitơ ở đktc là:
A. 336 lít
B. 168 lít
C. 224 lít
D. 112 lít
Lời giải:
m N2 = 280 g; MN2= 28 g/mol => nN2 = 10 mol
VN2 = 22,4 . nN2= 10 . 22,4 = 224 lít
Đáp án cần chọn là: C
Câu 14: Phải lấy bao nhiêu lít khí CO2 ở đktc để có 3,01.1023 phân tử CO2?
A. 11,2 lít
B. 33,6 lít
C. 16,8 lít
D. 22,4 lít
Lời giải:
1 mol CO2 chứa 6,02.1023 phân tử
=> 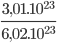 =0,5 mol CO2 chứa 3,01.1023 phân tử
=0,5 mol CO2 chứa 3,01.1023 phân tử
=> thể tích khí CO2 là: V = n.22,4 = 0,5.22,4 = 11,2 lít
Đáp án cần chọn là: A
Câu 15: 0,75 mol phân tử hyđro(đo ở đktc) chiếm thể tích bao nhiêu lít?
A. 22,4 lít
B. 24 lít
C. 11,2 lít
D. 16,8 lít
Lời giải:
Đáp án cần chọn là: D
Câu 16: Lấy 1 mol mỗi mẫu chất sau: H2O, HCl, Fe2O3, C6H12O6. Mẫu chất có khối lượng lớn nhất là
A. H2O
B. HCl
C. Fe2O3
D. C6H12O6
Lời giải:
Vì cùng lấy 1 mol chất => chất có khối lượng lớn nhất cũng là chất có khối lượng mol lớn nhất
Khối lượng mol của H2O là: M = 2.1 + 16 = 18 g/mol
Khối lượng mol của HCl là: M = 1 + 35,5 = 36,5 g/mol
Khối lượng mol của Fe2O3 là M = 56.2 + 16.3 = 160 g/mol
Khối lượng mol của C6H12O6 là: M = 12.6 + 12 + 16.6 = 180 g/mol
=> chất có khối lượng lớn nhất là C6H12O6
Đáp án cần chọn là: D
Câu 17: Tìm dãy tất cả kết quả đúng về số mol của những khối lượng chất sau: 197 g BaCO3 ; 49 gam H2SO4; 16g Fe2O3
A. 1 mol BaCO3; 0,5 mol H2SO4; 0,1 mol Fe2O3
B. 2 mol BaCO3; 0,5 mol H2SO4; 0,1 mol Fe2O3
C. 1 mol BaCO3; 5 mol H2SO4; 0,1 mol Fe2O3
D. 2 mol BaCO3; 0,5 mol H2SO4; 0,1 mol Fe2O3
Lời giải:
m BaCO3= 15 g; M BaCO3= 197 g/mol => n CaCO3 = 1 mol
m H2SO4 = 49 g; M H2SO4l = 98 g/mol => n H2SO4= 0,5 mol
m Fe2O3 = 16g; M Fe2O3 = 160g/mol => n CuO = 0,1 mol
Đáp án cần chọn là: A
Câu 18: Thể tích ở đktc của khối lượng các khí được biểu diễn ở 4 dãy sau. Dãy nào có tất cả các kết quả đúng với 2g H2; 5,6g N2; 7,2g O2; 22g CO2?
A. 4,8 lít H2; 22,4 lít N2; 4,48 lit O2; 5,6 lít CO2
B. 22,4 lít H2; 4,48 lít N2; 5,04 lit O2; 5,6 lít CO2
C. 22,4 lít H2; 2,4 lít N2; 4,48 lit O2; 11,2 lít CO2
D. 22,4 lít H2; 4,48 lít N2; 5,04 lit O2; 11,2 lít CO2
Lời giải:
m H2= 2 g; M H2= 2 g/mol => n H2 = 1 mol => VH2 = nH2 . 22,4 = 1 . 22,4 = 22,4 lít
m N2 = 5,6 g; M N2 = 28g/mol => n N2 = 0,2 mol => VN2 = nN2 . 22,4 = 0,2 . 22,4 = 4,48 lít
m O2 = 7,2 g; M O2= 32 g/mol => n O2= 0,225 mol => VO2= n O2 .22,4= 0,225. 22,4=5,04 lít
m CO2 = 22g; M CO2= 44g/mol => n CO2 = 0,5 mol => VCO2 = nCO2 . 22,4 = 0,5 . 22,4 = 11,2 lít
Đáp án cần chọn là: D
Câu 19: Tìm dãy kết quả tất cả đúng về khối lượng(g) của những lượng chất(mol) sau: 0,1mol S; 0,25 mol C; 0,6 mol Mg; 0,3 mol P
A. 3,2g S; 3,6g C; 14,4g Mg; 9,3g P
B. 3,4g S; 3g C, 14,4g Mg; 9,3g P
C. 3,2g S; 3g C; 14,4g Mg; 8,3g P
D. 3,2g S; 3g C; 14,4g Mg; 9,3g P
Lời giải:
nS = 0,1 mol; MS = 32g/mol => mS = nS . MS = 0,1 . 32 = 3,2 g
nC = 0,25 mol; MC = 12g/mol => mC = nC . MC = 0,25 . 12 = 3 g
nMg = 0,6 mol; M Mg = 24g/mol => m Mg = n Mg . M Mg = 0,6 . 24 = 14,4 g
nP = 0,3 mol; MP = 31g/mol => mP = nP . MP= 0,3 . 31 = 9,3 g
Đáp án cần chọn là: D
Câu 20: Công thức đúng chuyển đổi giữa thể tích chất khí (đktc) và lượng chất là:
A. 22,4.n.V =1
B. V = n.22,4
C. n = 22,4.V
D. V=22,4.N
Lời giải:
Công thức chuyển đổi giữa thể tích chất khí(đktc) và chất lượng là: V= n. 22,4
Đáp án cần chọn là: B
Câu 21: Công thức liên hệ giữa mol, khối lượng chất và phân tử khối của một chất là:
A. m= M× n
B. m= M : n
C. m= n : M
D. m.n. M =1
Lời giải:
Công thức liên hệ giữa mol, khối lượng chất và phân tử khối của một chất là: m= M × n
Đáp án cần chọn là: A
Câu 22: Công thức chuyển đổi giữa lượng chất (n) và thể tích của chất khí (V) ở điều kiện tiêu chuẩn là:
A. n =V. 22,4
B. n= 22,4/V
C. n = V/ 22,4
D. n. V = 22,4
Lời giải:
Công thức chuyển đổi giữa lượng chất (n) và thể tích của chất khí (V) ở điều kiện tiêu chuẩn là: n = V/ 22,4
Đáp án cần chọn là: C
Câu 23: Cho biết công thức tính số mol, khi đề bài cho biết khối lượng ( m):
A. m = n. M
B. 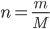
C. 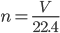
D. n = V. 22,4
Lời giải:
Cho biết công thức tính số mol, khi đề bài cho biết khối lượng (m):
Đáp án cần chọn là: B
Câu 24: Cho biết công thức tính số mol, khi đề bài cho biết thể tích (V) ở đktc:
A. m = n. M
B. 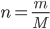
C. 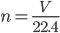
D. n = V. 22,4
Lời giải:
Cho biết công thức tính số mol, khi đề bài cho biết thể tích (V) ở đktc:
Đáp án cần chọn là: C
Câu 25: Nếu 2 chất khác nhau nhưng có ở cùng nhiệt độ và áp suất, có thể tích bằng nhau thì
A. Cùng khối lượng
B. Cùng số mol
C. Cùng tính chất hóa học
D. Cùng tính chất vật lí
Đáp án: B
Câu 26: Cho mCa = 5 g, mCaO = 5,6 g. Kết luận đúng
A. nCa > nCaO
B. nCa < nCaO
C. nCa = nCaO
D. VCa = VCaO
Đáp án: A
nCa = 5/20 = 0,25 mol & nCaO = 5,6/56 = 0,1(mol)
0,25 > 0,1 ⇒ nCa > nCaO
Câu 27: Cho nN2 = 0,9 mol và mFe = 50,4 g. Kết luận đúng
A. Cùng khối lượng
B. Cùng thể tích
C. Cùng số mol
D.mFe < mN2
Đáp án: C
nFe = 50,44/56 = 0,9 mol = nN2
Câu 28: Phải cần bao nhiêu mol nguyên tử C để có 2,4.1023 nguyên tử C
A. 0,5 mol
B. 0,55 mol
C. 0,4 mol
D. 0,45 mol
Đáp án: C
n = 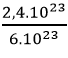
Câu 29: Số mol của 19,6 g H2SO4
A. 0,2 mol
B. 0,1 mol
C. 0,12 mol
D. 0,21 mol
Đáp án: A
n = 19,6/98 = 0,2 mol
Câu 30: Cho phương trình sau, tính khối lượng chất tạo thành biết 2,3 g Na
4Na + O2 → 2Na2O
A. 0,31 g
B. 3 g
C. 3,01 g
D. 3,1 g
Đáp án: D
nNa = 2,3/23 = 0,1 mol
4Na + O2 → 2Na2O
0,1→ 0,05 mol
mNa2O = 0,05.(23.2+16) = 3,1 g
Câu 31: Cho Fe + H2SO4 → FeSO4 + H2. Tính VH2 biết mFe = 15,12 g
A. 6,048 l
B. 8,604 l
C. 5,122 l
D. 2,45 l
Đáp án: A
nFe = 15,12/56 = 0,27 mol
Nhìn vào phương trình thấy nFe = nH2 = 0,27 (l)
⇒ VH2 = 22,4.0,27 = 6,048 l
Câu 32: Chọn đáp án đúng: Số mol của 12g O2, 1,2 g H2, 14 g N2
A. 0,375 mol; 0,6 mol; 0,5 mol
B. 0,375 mol; 0,5 mol; 0,1 mol
C. 0,1 mol; 0,6 mol; 0,5 mol
D. O,5 mol; 0,375 mol; 0,3 mol
Đáp án: A
Câu 33: Thể tích của CH4 ở đktc khi biết m = 96 g
A. 134,4 ml
B. 0,1344 ml
C. 13,44 ml
D. 1,344 ml
Đáp án: B
n = 96/16 = 6 mol
V = 22,4.6 = 134,4 (l) = 0,1344 (ml)
Câu 34: Số mol nguyên tử C trong 44 g CO2
A. 2 mol
B. 1 mol
C. 0,5 mol
D. 1,5 mol
Đáp án: B
nCO2 = 44/44 = 1 mol
Trong phân tử CO2 có một nguyên tử C nên nC= 1 mol