Tailieumoi.vn giới thiệu Giải bài tập hóa học 8 Bài 19: Chuyển đổi giữa khối lượng, thể tích và lượng chất, chi tiết nhất giúp học sinh dễ dàng làm bài tập Chuyển đổi giữa khối lượng, thể tích và lượng chất lớp 8.
Giải bài tập Hóa học lớp 8 Bài 19: Chuyển đổi giữa khối lượng, thể tích và lượng chất
Câu hỏi và bài tập (trang 67 sgk Hóa học lớp 8)
Nếu hai chất khí khác nhau mà có thể tích bằng nhau (đo cùng nhiệt độ và áp suất) thì:
a) Chúng có cùng số mol chất.
b) Chúng có cùng khối lượng .
c) Chúng có cùng số phân tử.
d) Không thể kết luận được điều gì cả.
Lời giải:
Vì V = n.22,4 nên 2 chất khí có cùng V => n cũng bằng nhau => sẽ có cùng số mol chất
a đúng
1 mol chứa 6.1023 nguyên tử hoặc phân tử nên cùng số mol sẽ có cùng số phân tử
c đúng
Khối lượng m = M.n phụ thuộc vào phân tử khối và nguyên tử khối. Mà 2 chất khí này khác nhau => Phân tử khối (M) khác nhau => Khối lượng (m) sẽ khác nhau
b sai
Vậy nếu hai chất khí ở cùng nhiệt độ và áp suất có thể tích bằng nhau thì chúng có cùng số mol hay có cùng số phân tử.
Kết luận đúng là a) và c).
Thế tích mol của chất khí phụ thuộc vào:
a) Nhiệt độ của chất khí ;
b) Khối lượng mol của chất khí ;
c) Bản chất của chất khí ;
d) Áp suất của chất khí.
Lời giải:Ở điều kiện tiêu chuẩn (00C, 1atm) 1 mol khí có thể tích là 22,4 lít
Ở điều kiện thường (200C, 1atm) 1 mol khí có thể tích là 24 lít
Thể tích phụ thuộc vào nhiệt độ và áp suất
a,d đúng
Với mọi chất khí ở đktc ta có V = n.22,4
Thể tích không phụ thuộc vào khối lượng mol của chất khí và bản chất của chất khí
b, c sai
a) Số mol của : 28 g Fe ; 64 g Cu ; 5,4 g Al.
b) Thể tích khí (đktc) của : 0,175 mol CO2 ; 1,25 mol H2 ; 3 mol N2.
c) Số mol và thể tích của hỗn hợp khí (đktc) gồm có : 0,44 g CO2 ; 0,04 g H2 và 0,56 g N2.
Lời giải:a)
b)
c)
a) 0,5 mol nguyên tử N ; 0,1 mol nguyên tử Cl ; 3 mol nguyên tử O.
b) 0,5 mol phân tử N2 ; 0,1 mol phân tử Cl2 ; 3 mol phân tử O2.
c) 0,10 mol Fe ; 2,15 mol Cu ; 0,80 mol H2SO4 ; 0,50 mol CuSO4.
Lời giải:a)
b)
c)
- Công thức chuyển đổi giữa lượng chất và khối lượng:
- Thể tích mol khí ở 20oC và 1 atm là 24 l. Nghĩa là 1 mol chất khí ở 20oC và 1 atm có thể tích là 24l
nên với n mol khí ta có thể tích: V = n.24 (l)
1g H2 ; 8 g O2 ;
3,5 g N2 ; 33 g CO2.
Lời giải:- Bước 1: Tính số mol của các khí ở điều kiện tiêu chuẩn
- Bước 2: Tính thể tích các khí ở điều kiện tiêu chuẩn V = n x 22,4
- Bước 3: Vẽ những hình khối chữ nhật qua đồ thị thể hiện thể tích các khí ( có 2 cạnh đáy bằng 1, chiều cao bằng thể tích của khí)
- Bước 4: So sánh
Ta có số mol của các khí ở điều kiện tiêu chuẩn là:
Bảng thể tích các khí ở điều kiện tiêu chuẩn:
|
Khí |
H2 |
O2 |
N2 |
CO2 |
|
n (mol) |
0,5 |
0,25 |
0,125 |
0,75 |
|
V (l) |
11,2 |
5,6 |
2,8 |
16,8 |
Từ đó ta vẽ được đồ thị so sánh thể tích các khí:

Tỷ lệ số mol các chất khí cũng chính là tỷ lệ về thể tích các khí nên thể tích khí
1. Chuyển đổi giữa lượng chất và khối lượng chất
Ví dụ: Tính khối lượng của 0,25 mol CO2? Biết khối lượng mol của CO2 là 44 g/mol
Hướng dẫn:
Khối lượng của 0,25 mol CO2 là :
Ta biết: 1 mol phân tử CO2 có khối lượng 44 gam
=> 0,25 mol phân tử CO2 có khối lượng x gam
=> x = 0,25.44 = 11 gam hay
* Công thức: m = n.M (gam)
Trong đó: n là số mol chất (mol)
M là khối lượng mol chất (g/mol)
m là khối lượng chất (gam)
Ta có 2 công thức liên quan sau: và
2. Chuyển đổi giữa lượng chất và thể tích chất khí
Ví dụ: 0,25 mol khí CO2 ở điều kiện tiêu chuẩn có thể tích là bao nhiêu lít?
Hướng dẫn:
1 mol khí ở điều kiện tiêu chuẩn chiếm 22,4 lít
=> 0,25 mol ở điều kiện tiêu chuẩn chiếm: 0,25.22,4 = 5,6 lít
* Công thức: V = n.22,4 (lít)
Trong đó: n là số mol chất (mol)
V : Thể tích chất ở điều kiện tiêu chuẩn (lít)
Ta có công thức liên quan:
Sơ đồ tư duy: Chuyển đổi giữa khối lượng thể tích và lượng chất.
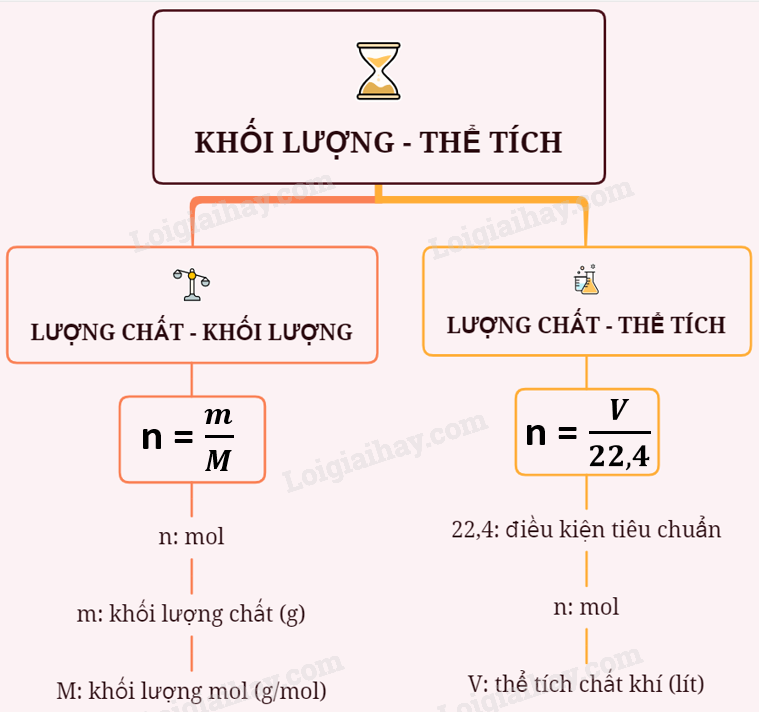
Dạng 1: Bài toán về sự chuyển đổi giữa số mol (n) và khối lượng (m)
Một số lưu ý cần nhớ:
Ta có công thức :
n = m : M
n : số mol
m : Khối lượng
M : Khối lượng mol
* Một số ví dụ điển hình:
Ví dụ 1: a, Tính số mol của 28 gam Fe; 60 gam Mg
b, Tính tổng số mol có trong hỗn hợp khí sau: 0,44 gam CO2; 0,04 gam H2; 0,56 gam N2
Lời giải:
a, n Fe = m : M = 28 : 56 = 0,5 mol
n Mg = m : M = 60: 24 = 2,5 mol
b, n CO2 = m : M = 0,44 : 44 = 0,01 mol
n H2 = 0,04 : 2 = 0,02 mol
n N2 = 0,56 : 28 = 0,02 mol
=> Tổng số mol khí có trong hỗn hợp X là:
0,01 + 0,02 + 0,02 = 0,05 mol
Ví dụ 2: Trong một binh trộn khí SO2 và SO3. Khi phân tích người ta thấy có 2,4 gam S và 2,8 gam oxi. Xác định tỉ số mol SO2 và SO3 trong bình sau khi trộn
Lời giải:
Gọi số mol SO2 là x => n S = x; n O = 2x
Gọi số mol SO3 là y => n S = y; n O = 3y
Ta có hệ phương trình:
(x + y) . 32 = 2,4
(2x + 3y) . 16 = 2,8
=> x = 0,05 ; y = 0,025
=> n SO2 : n SO3 = x : y = 0,05 : 0,025 = 2 :1
Ví dụ 3: Một hỗn hợp khí chứa 0,25 mol SO2; 0,15 mol khí CO2; 0,65 mol khí N2 và 0,45 mol khí H2
Tính khối lượng của hỗn hợp khí X trên
Lời giải:
Khối lượng của khí SO2 là:
m SO2 = n . M = 0,25 . 64 = 16 gam
Khối lượng của khí CO2 là:
m CO2 = n . M = 0,15 . 44 = 6,6 gam
Khối lượng của khí N2 là:
m N2 = n . M = 0,65 . 28 = 18,2 gam
Khối lượng của khí H2 là:
n H2 = n . M = 0,45 . 2 = 0,9 gam
=> Tổng khối lượng của hỗn hợp khí X là:
16 + 6,6 + 18,2 + 0,9 = 41,7 gam
Dạng 2: Bài toán về sự chuyển đổi giữa số mol (n) và thể tích (V)
* Một số lưu ý cần nhớ:
Xét khí ở điều kiện tiêu chuẩn ta có công thức như sau:
n = V : 22,4 (mol)
n : Số mol
V : Thể tích khí ở đktc
* Một số ví dụ điển hình
Ví dụ 1: Thể tích của hỗn hợp khí gồm 0,5 mol CO2, và 0,2 mol O2 ở điều kiện tiêu chuẩn là
Lời giải:
Thể tích của hỗn hợp khí gồm 0,5 mol CO2, và 0,2 mol O2 ở điều kiện tiêu chuẩn là
V = (0,5 +0,2).22,4 =15,68 lít
Ví dụ 2: Tính thể tích của các khí và hỗn hợp khí sau đây:
a, 0,05 mol khí SO2
b, Hỗn hợp khí X: 0,1 mol H2; 0,15 mol SO2; 0,2 mol CO2
Lời giải:
a, V SO2 = n . 22,4 = 0,05 . 22,4 = 1,12 lít
b, Thể tích của hỗn hợp khí X là:
(0,1 + 0,15 + 0,2) . 22,4 = 10,08 lít
Dạng 3: Bài toán về sự chuyển đổi giữa khối lượng (m) và thể tích (V)
* Một số lưu ý cần nhớ:
Nhớ lại 2 công thức tính quen thuộc:
n = m : M
n = V : 22,4 (công thức này áp dụng cho chất khí ở đktc)
Đối với dạng toán này, ta cần đổi số liệu đề bài cho ra n (mol) rồi sau đó mới tính toán theo yêu cầu của đề bài
* Một số ví dụ cụ thể:
Ví dụ 1: Thể tích của 280g khí Nitơ ở đktc là:
Lời giải:
m N2 = 280 g; MN2= 28 g/mol
=> nN2 = m : M = 280 : 28 = 10 mol
VN2 = nN2 . 22,4 = 10 . 22,4 = 224 lít
Ví dụ 2: 3,36 lít khí axetilen (C2H2) ở điều kiện tiêu chuẩn có khối lượng là
Lời giải:
Bước 1: Tính số mol:
Bước 2: Tính phân tử khối C2H2: MC2H2 = 2MC + 6M2 = 2.12 + 2.1 = 26 (g/mol)
Bước 3: Tính: mC2H2 = nC2H2×MC2H2 = 0,15×26 = 3,9 (g)
Ví dụ 3: Khối lượng nước mà trong đó có số phân tử bằng số phân tử có trong 20 gam NaOH là
Lời giải:
Khối lượng mol của NaOH là: M = 23 + 16 + 1 = 40 g/mol
=> số mol NaOH là:
=> số mol của H2O là 0,5 mol
Khối lượng mol của H2O là: M = 2 + 16 = 18 g/mol
=> khối lượng nước là: m = n . M = 0,5.18 = 9 gam