Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 8 Bài 19: Sự chuyển đổi giữa khối lượng, thể tích và lượng chất chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 8. Mời các bạn đón xem:
Giải SBT Hóa học 8 Bài 19: Sự chuyển đổi giữa khối lượng, thể tích và lượng chất
Bài 19.1 trang 27 SBT Hóa học 8: Hãy cho biết số mol của những khối lượng chất sau :
a) 4 g cacbon ; 62 g photpho ; 42 g sắt.
b) 3,6 g nước ; 95,48 g khí cacbonic ; 14,625 g muối ăn.
Lời giải:
Số mol của những lượng chất :
a) ;
b)
Bài 19.2 trang 27 SBT Hóa học 8: Hãy tìm thể tích khí ở đktc của:
Lời giải:
- VCO2 = nCO2 . 22,4 = 0,25.22,4 = 5,6 (l)
- VO2 = nO2.22,4 = 0,25.22,4 = 5,6 (l)
- nN2 == 0,75(mol)
→VN2 = nN2.22,4 = 0,75.22,4= 16,8 (l)
-nCO2== 0,2 (mol)
→VCO2 = nCO2. 22,4 = 0,2.22,4 = 4,48 (l)
-nH2==1,5(mol)
→VH2 = nH2. 22,4 = 1,5. 22,4 = 33,6 (l)
-nCO== 0,05(mol)
→VCO = nCO. 22,4 = 0,05. 22,4 = 1,12 (l)
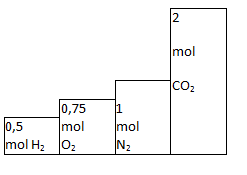
Bài 19.3 trang 27 SBT Hóa học 8: Vẽ biểu đồ là những hình chữ nhật để so sánh thể tích những khí sau ở đktc.
a) 1 g khí hiđro ;
b) 24 g khí oxi ;
c) 28 g khí nitơ ;
d) 88 g khí cacbonic.
Phương pháp giải:
+) Áp dụng công thức : m=M.n để tính số mol các chất.
+) Tỉ lệ thể tích chính là tỉ lệ số mol => Vẽ biểu đồ.
Lời giải:
Tỉ lệ thể tích cũng chính là tỉ lệ về số mol nên ta có biểu đồ sau:
Bài 19.4 trang 27 SBT Hóa học 8: Hãy cho biết:
a) Số mol và số nguyên tử của : 28 g sắt (Fe) ; 6,4 g đồng (Cu) ; 9 g nhôm (Al).
b) Khối lượng và thể tích khí (đktc) của : 2 mol H2 ; 1,5 mol O2; 1,15 mol CO2 ; 1,15 mol CH4.
Phương pháp giải:
a) Áp dụng công thức m= M x n
1 mol = 6 x 1023 nguyên tử hoặc phân tử chất.
b) Áp dụng công thức m = M x n và V = 22,4 x n
Lời giải:
a) 28g Fe có số mol là và số nguyên tử là
nguyên tử (hoặc 0,5N nguyên tử).
6,4 g Cu có số mol là và số nguyên tử là
nguyên tử ( hoặc 0,1N nguyên tử)
9g Al có số mol là và số nguyên tử là
nguyên tử ( hoặc nguyên tử )
b)
Bài 19.5 trang 27 SBT Hóa học 8: Hãy tìm khối lượng của những đơn chất và hợp chất sau : CO2, H2O, N2, O2, H2, NaCl để cùng có số phân tử bằng nhau là 0,6.1023.
Phương pháp giải:
Một mol chất (đơn chất hay hợp chất) là lượng chất có chứa 6 x 1023 phân tử (hoặc nguyên tử).
Áp dụng công thức m= M x n
Lời giải:
Một mol chất (đơn chất hay hợp chất) là lượng chất có chứa 6 x 1023 phân tử (hoặc nguyên tử). Theo đề bài thì 0,6 x 1023 phân tử các chất là số phân tử có trong 0,1 mol chất. Vậy khối lượng các chất sẽ là :
-
-
-
-
-
-
Bài 19.6 trang 27 SBT Hóa học 8: Phải lấy bao nhiêu gam của mỗi chất khí sau để chúng cùng có thể tích khí là 5,6 lít ở đktc ?
a) CO2 ; b) CH4 ; c) O2 ; d) N2 ; e) Cl2.
Phương pháp giải:
+) Áp dụng công thức V= 22,4 x n => số mol của mỗi chất.
+) Áp dụng công thức m = M x n => khối lượng của mỗi chất.
Lời giải:
Biết 5,6 lít khí ở đktc có số mol là . Để có thể tích các khí bằng nhau là 5,6 lít (đktc), ta phải lấy 0,25 mol của mỗi chất khí. Chúng có khối lượng là:
-
-
-
-
-