Tài liệu Đề thi Hóa học lớp 11 Học kì 1 năm 2022 có ma trận (8 đề) tổng hợp từ đề thi môn Hóa học 11 của các trường THPT trên cả nước đã được biên soạn chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi học kì 1 Hóa học lớp 11. Mời các bạn cùng đón xem:
MA TRẬN ĐỀ KIỂM TRA HỌC KỲ 1 - NĂM HỌC 2022-2023
MÔN HÓA: 11
(Trắc nghiệm 30 câu × \(\frac{1}{3}\) điểm = 10,0 điểm)
|
Chủ đề |
CẤP ĐỘ |
||
|
Nhận biết |
Thông hiểu |
Vận dụng |
|
|
1. Sự điện li |
- Biết chất điện li mạnh, yếu. - Biết được axit, bazơ, muối, hiđroxit lưỡng tính. - Biết được môi trường theo pH. |
- Hiểu bản chất, điều kiện xảy ra phản ứng trao đổi ion trong dung dịch chất điện li. |
- Tính pH của dung dịch. - Viết được phương trình ion thu gọn. - Giải một số bài tập theo phương pháp bảo toàn điện tích. |
|
Số câu: 10 Số điểm: \(\frac{{10}}{3}\) Tỉ lệ%: 33,33% |
Số câu: 5 Số điểm \(\frac{5}{3}\) Tỉ lệ: 16,67% |
Số câu: 2 Số điểm: \(\frac{2}{3}\) Tỉ lệ: 6,67% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
|
2. Nitơ - photpho |
- Biết tính chất hóa học, ứng dựng, điều chế nitơ. - Biết tính chất hóa học của amoniac, muối amoni. - Phương pháp điều chế N2, NH3, HNO3. - Biết tính chất hóa học của P và H3PO4. - Biết vai trò các loại phân bón và biết một số loại phân bón cơ bản. |
- Hiểu được tính chất hóa học của axit HNO3, tính chất của các muối nitrat. - Biết được cách tính độ dinh dưỡng của phân bón. |
Giải bài tập bảo toàn electron khi cho kim loại tác dụng với HNO3. - Giải bài tập khi cho dung dịch kiềm như NaOH, KOH tác dụng với H3PO4. - Giải một số bài tập tìm kim loại hoặc xác định sản phẩm khử của nitơ. - Giải bài tập về tổng hợp NH3. |
|
Số câu: 10 Số điểm: \(\frac{{10}}{3}\) Tỉ lệ%: 33,33% |
Số câu: 4 Số điểm: \(\frac{4}{3}\) Tỉ lệ: 13,33% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
|
3. Cacbon và hợp chất của các bon |
Biết được tính chất hóa học và ứng dụng của cacbon và một số hợp chất hay gặp. |
|
- Giải bài tập về CO khử oxit kim loại. - Giải bài tập về muối cacbanat |
|
Số câu: 3 Số điểm: 1 Tỉ lệ%: 10% |
Số câu: 2 Số điểm: \(\frac{2}{3}\) Tỉ lê: 6,67% |
|
Số câu: 1 Số điểm: \(\frac{1}{3}\) Tỉ lê: 3,33% |
|
4. Đại cương hóa học hữu cơ |
- Biết một số đặc điểm của hợp chất hữu cơ. - Biết cách phân loại hợp chất hữu cơ. - Nắm được khái niệm công thức phân tử, công thức đơn giản nhất. |
- Hiểu được đồng đẳng, đồng phân. - Biết cách viết công thức cấu tạo. |
- Giải bài tập xác định công thức phân tử theo % khối lượng và từ công thức đơn giản nhất. - Vận dụng phương pháp bảo toàn nguyên tố, bảo toàn khối lượng giải bài tập đốt cháy hợp chất hữu cơ. |
|
Số câu: 7 Số điểm: \(\frac{7}{3}\) Tỉ lệ%: 23,33% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
Số câu: 2 Số điểm: \(\frac{2}{3}\) Tỉ lệ: 6,67% |
Số câu: 2 Số điểm: \(\frac{2}{3}\) Tỉ lệ: 6,67% |
|
Tổng số câu: 30 Tổng số điểm: 10 Tỉ lệ% = 100% |
Số câu: 14 Số điểm: \(\frac{{14}}{3}\) Tỉ lệ: 46,67% |
Số câu: 7 Số điểm: \(\frac{7}{3}\) Tỉ lệ: 23,33% |
Số câu: 9 Số điểm: 3 Tỉ lệ: 30% |
Đề thi Hóa học lớp 11 Học kì 1 năm 2022 có ma trận (8 đề) - Đề 1
Phòng Giáo dục và Đào tạo ...
Đề thi Học kì 1
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 1)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: ..................................................................... Lớp: .............................
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; S = 32; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137)
Câu 1: Hợp chất nào sau đây có tính lưỡng tính?
A. Al(OH)3.
B. Ba(OH)2.
C. Fe(OH)2.
D. Cr(OH)2.
Câu 2: Trộn 200 ml dung dịch chứa 12 gam MgSO4 với 300 ml dung dịch chứa 34,2 gam Al2(SO4)3 thu được dung dịch X. Nồng độ ion \(SO_4^{2 - }\) trong X là
A. 0,2M.
B. 0,8M.
C. 0,6M.
D. 0,4M.
Câu 3: Trộn 200 ml dung dịch gồm HCl 0,1M vá H2SO4 0,15M với 300 ml dung dịch
Ba(OH)2 nồng độ aM, thu được m gam kết tủa và 500 ml dung dịch có pH = 1. Giá trị của a và m lần lượt là
A. 0,15 và 2,330.
B. 0,10 và 6,990.
C.0,10 và 4,660.
D. 0.05 và 3,495.
Câu 4: Cho 10 ml dung dịch X chứa HCl 1M và H2SO4 0,5M. Thể tích dung dịch NaOH 1M cần đẻ trung hòa dung dịch X là:
A. 10 ml.
B. 15 ml.
C. 20 ml.
D. 25 ml.
Câu 5: Phương trình điện li nào sau đây viết đúng?
A. H2SO4 ⇄ H+ + \(HSO_4^ - \)
B. H2CO3 ⇄ 2H+ + \(HCO_3^ - \)
C. H2SO3 → 2H+ + \(SO_3^{2 - }\)
D. Na2S ⇄ 2Na+ + \({S^{2 - }}\)
Câu 6: Axit nào sau đây là axit một nấc?
A. H2SO4
B. H2CO3
C. CH3COOH
D. H3PO4
Câu 7: A là dung dịch HNO3 0,01M; B là dung dịch H2SO4 0,005M. Trộn các thể tích bằng nhau của A và B được dung dịch X. Tính pH của dung dịch X
A. 1
B. 2
C. 3
D. 4
Câu 8: Phương trình: \({S^{2 - }}\) + 2H+ → H2S là phương trình ion rút gọn của phản ứng nào?
A. FeS + 2HCl → FeCl2 + H2S↑.
B. 2NaHSO4 + 2Na2S → 2Na2SO4 + H2S↑
C. 2HCl + K2S → 2KCl + H2S↑.
D. BaS + H2SO4 → BaSO4↓ + H2S↑.
Câu 9: Cho các dung dịch axit có cùng nồng độ mol: H2S, HCl, H2SO4, H3PO4, dung dịch có nồng độ H+ lớn nhất là:
A. H2SO4
B. H2S
C. HCl
D. H3PO4
Câu 10: Cho 4 dung dịch trong suốt, mỗi dung dịch chỉ chứa một loại cation và một loại anion trong các ion sau: Ba2+, Al3+, Na+, Ag+, \(CO_3^{2 - }\), \(NO_3^ - \), \(C{l^ - }\), \(SO_4^{2 - }\). Các dung dịch đó là:
A. BaCl2, Al2(SO4)3, Na2CO3, AgNO3.
B. Ba(NO3)2, Al2(SO4)3, Na2CO3, AgCl.
C. BaCl2, Al2(SO4)3, Na2CO3, AgNO3.
D. Ba(NO3)2, Al2(SO4)3, NaCl, Ag2CO3.
Câu 11: Trong công nghiệp, N2 được tạo ra bằng cách nào sau đây?
A. Nhiệt phân muối NH4NO3 đến khối lượng không đổi.
B. Chưng cất phân đoạn không khí lỏng.
C. Phân hủy NH3.
D. Đun nóng Mg với dung dịch HNO3 loãng.
Câu 12: Tìm phản ứng viết sai:
A. NH4NO3 NH3 + HNO3
B. (NH4)2CO3 2NH3 + CO2 + H2O
C. NH4Cl NH3 + HCl
D. NH4HCO3 NH3 + CO2 + H2O
Câu 13: Cho những cặp chất sau: (1) C và CO, (2) CO2 và dung dịch Ba(OH)2, (3) CO và CaO, (4) CO2 và Al. Các cặp chất không có phản ứng xảy ra là:
A. (1) và (3).
B. (2) và (3).
C. (3) và (4).
D. (1) và (2).
Câu 14: Loại phân đạm nào sau đây có độ dinh dưỡng cao nhất?
A. (NH4)2SO4.
B. (NH2)2CO.
C. NH4NO3.
D. NH4Cl.
Câu 15: Thêm 0,15 mol KOH vào dung dịch chứa 0,1 mol H3PO4. Sau phản ứng trong dung dịch chứa:
A. KH2PO4 và K3PO4.
B. K2HPO4 và K3PO4.
C. KH2PO4 và K2HPO4.
D. K3PO4 và KOH dư.
Câu 16: Cho các chất KNO3, Fe(NO3)3, Zn(NO3)2, Fe(NO3)2. Số chất khi bị nhiệt phân thu được hỗn hợp khí NO2, O2 là:
A. 4.
B. 3
C. 2
D. 1
Câu 17: Điều khẳng định nào sau đây đúng khi nói về tính chất hóa học của NH3. NH3 có:
A. tính oxi hoá
B. tính khử và tính bazơ yếu
C. tính khử
D. tính bazơ yếu
Câu 18: Hòa tan hỗn hợp gồm 0,1 mol Al và 0,2 mol Zn bằng 500 ml dung dịch HNO3 vừa đủ, thu được dung dịch A và không thấy khí thoát ra. Cô cạn dung dịch A thu m gam muối. Giá trị của m là:
A. 51,9 gam
B. 66,1 gam
C. 59,1 gam
D. 61,6 gam
Câu 19: Tìm phương trình hóa học viết sai?
A. 2P + 3Ca Ca3P2
B. 4P + 5O2 (dư) 2P2O5
C. PCl3 + 3H2O → H3PO3 + 3HCl
D. P2O3 + 3H2O → 2H3PO4
Câu 20: Kim loại Cu tan trong dung dịch axit HNO3 nhận thấy thoát ra khí X có màu nâu đỏ, là sản phẩm khử duy nhất. Vậy X là
A. NO.
B. NO2.
C. N2.
D. N2O.
Câu 21: Tính bazơ của NH3 do:
A. Trên nitơ còn cặp e tự do.
B. Phân tử có 3 liên kết cộng hóa trị phân cực.
C. NH3 tan được nhiều trong H2O.
D. NH3 tác dụng với H2O tạo NH4OH.
Câu 22: Nung hoàn toàn 10 gam CaCO3 ở 10000C thu được V lít khí CO2 thoát ra ở đktc. Giá trị của V là:
A. 2,24 lít.
B. 1,12 lít.
C. 0,112 lít.
D. 4,48 lít.
Câu 23: Tính oxi hóa của cacbon thể hiện ở phản ứng
A. C + O2 CO2.
B. C + 2CuO 2Cu + CO2.
C. 3C + 4Al Al4C3.
D. C + H2O CO + H2.
Câu 24: Hợp chất hữu cơ được phân loại như sau:
A. Hiđrocacbon và hợp chất hữu cơ có nhóm chức.
B. Hiđrocacbon và dẫn xuất của hiđrocacbon.
C. Hiđrocacbon no, không no, thơm và dẫn xuất của hiđrocacbon.
D. Tất cả đều đúng.
Câu 25: Chất nào sau đây là dẫn xuất của hiđrocacbon?
A. CH4
B. C2H6
C. C6H6
D. C3H6Br.
Câu 26: Đốt cháy hoàn toàn 8,8 gam hợp chất hữu cơ X (C, H, O), thu được 8,96 lít CO2 (đktc) và 7,2 gam H2O. Biết tỉ khối của X so với CO2 là 2. Công thức phân tử của X là:
A. C2H4O
B. C5H12O
C. C4H8O2
D. C3H4O3.
Câu 27: Phản ứng hóa học của các chất hữu cơ thường:
A. xảy ra nhanh và tạo ra hỗn hợp sản phẩm.
B. xảy ra chậm và tạo ra một sản phẩm duy nhất.
C. xảy ra chậm và tạo ra hỗn hợp sản phẩm.
D. xảy ra nhanh và tạo ra một sản phẩm duy nhất.
Câu 28: Khi phân tích một hợp chất hữu cơ (X) có thành phần như sau: %C = 52,17%; %H = 13,04% và %O = 34,78%. Biết công thức đơn giản nhất trùng với công thức phân tử. Công thức phân tử của (X) là:
A. C2H6O.
B. C3H8O.
C. CH4O.
D. C4H10O.
Câu 29: Trong những dãy chất sau đây, dãy nào có các chất là đồng phân của nhau?
A. C2H5OH, CH3OCH3.
B. CH3OCH3, CH3CHO.
C. CH3CH2CH2OH, C2H5OH.
D. C4H10, C6H6.
Câu 30: Số công thức cấu tạo có thể có ứng với các công thức phân tử C4H10 là:
A. 1
B. 2
C. 3
D. 4.
--- Hết ---
Giám thị không giải thích thêm
Đề thi Hóa học lớp 11 Học kì 1 năm 2022 có ma trận (8 đề) - Đề 2
Phòng Giáo dục và Đào tạo ...
Đề thi Học kì 1
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 2)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: ..................................................................... Lớp: .............................
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; S = 32; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137)
Câu 1: Cho các chất: phèn K – Al; C2H5OH; glucozơ; saccarozơ; tinh bột; dầu ăn; CH3COOH; HCOOCH3; CH3CHO; C3H6; Ca(OH)2; CH3COONH4; NaHCO3; KAlO2; C2H4(OH)2; Phèn amoni – sắt. Số chất điện li là:
A. 6
B. 7
C. 9
D. 8
Câu 2: Một dung dịch chứa các ion: Cu2+ (0,02 mol), K+ (0,10 mol), \(NO_3^ - \) (0,05 mol) và \(SO_4^{2 - }\) (x mol). Giá trị của x là:
A. 0,050.
B. 0.070.
C. 0,030.
D. 0,045.
Câu 3: Cho các dung dịch axit có cùng nồng độ mol: H2S, HCl, H2SO4, H3PO4, dung dịch có nồng độ H lớn nhất là:
A. H2SO4
B. H2S
C. HCl
D. H3PO4
Câu 4: Theo thuyết Areniut, kết luận nào sau đây đúng?
A. Bazơ là chất khi tan trong nước phân li cho anion OH.
B. Bazơ là những chất có khả năng phản ứng với axit.
C. Một bazơ không nhất thiết phải có nhóm OH trong thành phần phân tử.
D. Bazơ là hợp chất trong thành phần phân tử có một hay nhiều nhóm OH.
Câu 5: Trộn V1 ml dung dịch NaOH có pH = 13 với V2 ml dung dịch Ba(OH)2 có pH = 11, thu được dung dịch mới có pH = 12. Tỉ số V1 : V2 có giá trị là:
A. 1:1
B. 2:1
C. 1:10
D. 10:1
Câu 6: Chỉ dùng quỳ tím, có thể nhận biết ba dung dịch riêng biệt nào sau đây?
A. HCl, NaNO3, Ba(OH)2.
B. H2SO4, HCl, KOH.
C. H2SO4, NaOH, KOH.
D. Ba(OH)2, NaCl, H2SO4
Câu 7: Phản ứng hóa học nào sau đây có phương trình ion thu gọn là H+ + \(O{H^ - }\) → H2O?
A. HCl + NaOH → H2O + NaCl
B. NaOH + NaHCO3 → H2O + Na2CO3
C. H2SO4 + BaCl2 → 2HCl + BaSO4↓
D. H2SO4 + Ba(OH)2 → 2H2O + BaSO4↓
Câu 8: Dung dịch H2SO4 0,10 M có:
A. pH = 1
B. pH < 1
C. pH > 1
D. [H+] > 2,0M
Câu 9: Không thể có dung dịch chứa đồng thời các ion:
A. Ba2+, \(O{H^ - }\), Na+, \(SO_4^{2 - }\)
B. K+, \(C{l^ - }\), \(O{H^ - }\), Ca2+.
C. Ag+, \(NO_3^ - \), \(C{l^ - }\), H+
D. A và C đúng.
Câu 10: Cho các phản ứng xảy ra trong dung dịch:
(1) BaS + H2SO4
(2) AgNO3 + (NH4)3PO4
(3) Na2CO3 + CaCl2
(4) Mg(HCO3)2 + HCl
(5) (NH4)2SO4 + KOH
(6) NH4HCO3 + Ba(OH)2
Trong số các phản ứng trên, số phản ứng thu được sản phẩm đồng thời có cả kết tủa và khí bay ra là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 11: Chất nào tác dụng với N2 ở nhiệt độ thường
A. Mg.
B. O2.
C. Na.
D. Li.
Câu 12: Phân đạm cung cấp nitơ hóa hợp cho cây dưới dạng:
A. N2.
B. \(NH_4^ + \), \(NO_3^ - \).
C. NH3.
D. HNO3.
Câu 13: Để thu được muối photphat trung hòa, cần V ml dung dịch NaOH 1M cho tác dụng với 50 ml dung dịch H3PO4 0,5M. Giá trị của V là
A. 75 ml.
B. 100 ml.
C. 50 ml.
D. 25 ml.
Câu 14: Cho m gam Al phản ứng hoàn toàn với dung dịch HNO3 loãng (dư), thu được 4,48 lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của m là
A. 8,10 gam.
B. 2,70 gam.
C. 5,40 gam.
D. 4,05 gam.
Câu 15: Kim loại không tan trong dung dịch HNO3 đặc, nguội là:
A. Mg.
B. Al.
C. Zn.
D. Cu.
Câu 16: Sản phẩm của phản ứng nhiệt phân AgNO3 là:
A. Ag2O, NO, O2.
B. AgNO2, O2.
C. Ag(NO3)2, NO2, O2.
D. Ag, NO2, O2.
Câu 17: Cho 44 gam NaOH vào dung dịch chứa 39,2 gam H3PO4. Sau khi phản ứng xảy ra hoàn toàn, đem cô cạn dung dịch thu được. Muối được tạo thành và khối lượng tương ứng là:
A. Na3PO4: 50 gam.
B. Na2HPO4: 14,2 gam và Na3PO4: 49,2 gam.
C. Na2HPO4: 15 gam.
D. Na2HPO4: 49,2 gam và Na3PO4: 14,2 gam.
Câu 18: Thành phần chính của phân supephotphat kép là
A. CaHPO4.
B. Ca(H2PO4)2 và CaSO4.
C. Ca(H2PO4)2.
D. CaHPO4 và CaSO4.
Câu 19: Nước đá khô (CO2 rắn) dùng để tạo môi trường lạnh và khô trong việc bảo quản hoa quả tươi vì:
A. nước đá khô có khả năng hút ẩm.
B. nước đá khô có khả năng thăng hoa.
C. nước đá khô có khả năng khử trùng.
D. nước đá khô dễ hoá lỏng.
Câu 20: Cho 3,36 lít khí CO (đktc) phản ứng vừa đủ với 20 gam hỗn hợp X gồm CuO và Al2O3 nung nóng. Phần trăm khối lượng của Al2O3 trong X là
A. 40%.
B. 80%.
C. 60%.
D. 20%.
Câu 21: Kim loại Cu tan trong dung dịch axit HNO3 nhận thấy thoát ra khí X có màu nâu đỏ, là sản phẩm khử duy nhất. Vậy X là
A. NO.
B. NO2.
C. N2.
D. N2O.
Câu 22: Chất nào sau đây có thể làm khô khí NH3 có lẫn hơi nước?
A. P2O5.
B. H2SO4 đặc.
C. CuO bột.
D. NaOH rắn.
Câu 23: Na2CO3 lẫn tạp chất là NaHCO3. Cách nào sau đây có thể thu được Na2CO3 tinh khiết?
A. hòa tan vào nước rồi lọc.
B. nung nóng.
C. cho tác dụng với NaOH dư.
D. cho tác dụng với dung dịch Ca(OH)2 dư.
Câu 24: Số công thức cấu tạo có thể có ứng với các công thức phân tử C4H10O là:
A. 8
B. 6
C. 7
D. 5.
Câu 25: Hợp chất hữu cơ X có công thức đơn giản nhất là C2H4O. Tỉ khối hơi của X so với hiđro bằng 44. Công thức của phân tử X là:
A. C2H4O
B. C5H12O
C. C4H8O2
D. C3H4O3.
Câu 26: Cặp chất nào sau đây là đồng phân của nhau?
A. C2H5OH, CH3OCH3.
B. CH3OCH3, CH3CHO.
C. CH3OH, C2H5OH.
D. CH3CH2Cl, CH3CH2OH.
Câu 27: Đốt cháy hoàn toàn 100 ml hợp chất hữu cơ X, cần hết 300 ml O2, thu được 200 ml CO2 và 300 ml hơi nước. Các khí được đo ở cùng nhiệt độ, áp suất. Công thức phân tử của X là:
A. C2H6O
B. C2H6O2
C. C2H4O
D. C3H6O2.
Câu 28: Liên kết hóa học trong phân tử chất hữu cơ chủ yếu là liên kết
A. cộng hóa trị
B. ion
C. kim loại
D. hiđro.
Câu 29: Trong thành phần phân tử hợp chất hữu cơ nhất thiết phải có nguyên tố nào?
A. Cacbon
B. Hiđro
C. Oxi
D. Nitơ.
Câu 30: Phản ứng hóa học của các hợp chất hữu cơ có đặc điểm là :
A. thường xảy ra rất nhanh và cho một sản phẩm duy nhất.
B. thường xảy ra chậm, không hoàn toàn, không theo một hướng nhất định.
C. thường xảy ra rất nhanh, không hoàn toàn, không theo một hướng nhất định.
D. thường xảy ra rất chậm, nhưng hoàn toàn, không theo một hướng xác định.
--- Hết ---
Giám thị không giải thích thêm
Đề thi Hóa học lớp 11 Học kì 1 năm 2022 có ma trận (8 đề) - Đề 3
Phòng Giáo dục và Đào tạo ...
Đề thi Học kì 1
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 3)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: ..................................................................... Lớp: .............................
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; S = 32; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137)
Câu 1: Theo A-rê-ni-ut, chất nào sau đây là bazơ?
A. KOH.
B. CH3COONa.
C. H2SO4.
D. NaCl.
Câu 2: Chất nào sau đây thuộc loại chất điện li mạnh?
A. H2O.
B. NaCl.
C. C2H5OH.
D. CH3COOH.
Câu 3: Hợp chất nào sau đây có tính lưỡng tính?
A. Al(OH)3.
B. Ba(OH)2.
C. Fe(OH)2.
D. Cr(OH)2.
Câu 4: Dung dịch chất nào sau đây làm xanh quỳ tím?
A. Na2SO4.
B. NaOH.
C. HCl.
D. KCl.
Câu 5: Cho các muối sau đây: NaNO3; K2CO3; CuSO4; FeCl3; AlCl3; KCl. Các dung dịch có pH = 7 là:
A. NaNO3; KCl.
B. K2CO3; CuSO4; KCl.
C. CuSO4; FeCl3; AlCl3.
D. NaNO3; K2CO3; CuSO4.
Câu 6: Một dung dịch chứa các ion: Cu2+ (0,02 mol), K+ (0,10 mol), \(NO_3^ - \) (0,05 mol) và \(SO_4^{2 - }\) (x mol). Giá trị của x là:
A. 0,050.
B. 0.070.
C. 0,030.
D. 0,045.
Câu 7: Cho dung dịch chứa các ion sau: Na+, Ca2+, Mg2+, Ba2+, H+, \(NO_3^ - \). Muốn tách được nhiều cation ra khỏi dung dịch mà không đưa ion lạ vào dung dịch người ta dùng:
A. dung dịch K2CO3vừa đủ.
B. dung dịch Na2SO4 vừa đủ.
C. dung dịch KOH vừa đủ.
D. dung dịch Na2SO3 vừa đủ.
Câu 8: A là dung dịch HNO3 0,01M; B là dung dịch H2SO4 0,005M. Trộn các thể tích bằng nhau của A và B được dung dịch X. Tính pH của dung dịch X
A. 1
B. 2
C. 3
D. 4
Câu 9: Phương trình ion rút gọn: H+ + \(HCO_3^ - \) → CO2 ↑ + H2O
Tương ứng với phương trình hóa học dạng phân tử nào sau đây?
(1) 2HCl + Na2CO3 → 2NaCl + CO2 ↑ + H2O
(2) 2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 ↑ + 2H2O
(3) CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2O
(4) Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 ↑ + 2H2O
A. 1, 2
B. 2, 3
C. 2, 4
D. 1, 3
Câu 10: Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong dung dịch?
A. AlCl3 và Na2CO3.
B. HNO3 và NaHCO3.
C. NaAlO2 và KOH.
D. NaCl và AgNO3.
Câu 12: Trong phản ứng nào sau đây, nitơ thể hiện tính khử?
A. N2 + 3H2 2NH3
B. N2 + 6Li 2Li3N
C. N2 + O2 2NO
D. N2 + 3Mg Mg3N2
Câu 13: Hàm lượng KCl có trong một loại phân kali có độ dinh dưỡng 50% là:
A. 79,26%.
B. 95.51%.
C. 31,54%.
D. 26,17%.
Câu 14: Cho 44 gam NaOH vào dung dịch chứa 39,2 gam H3PO4. Sau khi phản ứng xảy ra hoàn toàn. Đem cô cạn dung dịch đến khô, thu được lượng muối khan là:
A. 50 gam Na3PO4.
B. 15 gam Na2HPO4.
C. 19,2 gam NaH2PO4 và 14,2 gam NaH2PO4.
D. 14,2 gam NaH2PO4 và 49,2 gam Na3PO4.
Câu 15: Cho 8 gam Cu tác dụng với 120 ml dung dịch X gồm HNO3 1M và H2SO4 0,5M thu được V lít khí NO (đktc). Tính V?
A. 1,244 lít
B. 1,68 lít
C. 1,344 lít
D. 1,12 lít
Câu 16: Trong các nhận định sau nhận định nào đúng:
A. Mặc dù độ âm điện của photpho nhỏ hơn nitơ nhưng photpho hoạt động hóa học mạnh hơn nitơ là do liên kết trong phân tử photpho kém bền hơn trong phân tử nitơ.
B. Nitơ hoạt động hóa học yếu hơn photpho là do nitơ có độ âm điện kém hơn photpho.
C. Ở nhiệt độ thường, nitơ và photpho đều trơ về mặt hóa học.
D. Nitơ có độ âm điện nhỏ hơn photpho nên hoạt động hóa học mạnh hơn.
Câu 17: Cacbon vô định hình được điều chế từ than gỗ hay gáo dừa có tên là than hoạt tính. Tính chất nào của than hoạt tính giúp con người chế tạo các thiết bị phòng độc, lọc nước?
A. Than hoạt tính dễ cháy.
B. Than hoạt tính có cấu trúc lớp.
C. Than hoạt tính có khả năng hấp phụ cao.
D. Than hoạt tính có khả năng hòa tan tốt trong nhiều dung môi.
Câu 18: X là muối khi tác dụng với dung dịch NaOH dư sinh khí mùi khai, tác dụng với dung dịch BaCl2 sinh kết tủa trắng không tan trong HNO3. X là muối nào trong số các muối sau?
A. (NH4)2CO3.
B. (NH4)2SO3.
C. NH4HSO3.
D. (NH4)3PO4.
Câu 19: Thực hiện phản ứng giữa H2 và N2 (tỉ lệ mol 4 : 1) trong bình kín có xúc tác, thu được hỗn hợp khi có áp suất giảm 9% so với ban đầu (trong cùng điều kiện). Hiệu suất phản ứng là:
A. 20%.
B. 22,5%.
C. 25%.
D. 27%.
Câu 20: Trong phòng thí nghiệm thường điều chế HNO3 bằng phản ứng:
A. NaNO3 + H2SO4 (đ) HNO3 + NaHSO4.
B. 4NO2 + 2H2O + O2 → 4HNO3.
C. N2O5 + H2O → 2HNO3.
D. 2Cu(NO3)2 + 2H2O → Cu(OH)2 + 2HNO3.
Câu 21: Trong bình kín chứa 0,5 mol CO và m gam Fe3O4. Đun nóng bình cho tới khi phản ứng xảy ra hoàn toàn thì khí trong bình có tỉ khối so với khí CO ban đầu là 1,457. Giá trị của m là:
A. 17,4.
B. 11,6.
C. 22,8.
D. 23,2.
Câu 22: Cho P tác dụng với Ca, sản phẩm thu được là:
A. Ca3P2.
B. Ca2P3.
C. Ca3(PO4)2.
D. CaP2.
Câu 23: Tính oxi hóa của cacbon thể hiện ở phản ứng
A. C + O2 CO2.
B. C + 2CuO 2Cu + CO2.
C. 3C + 4Al Al4C3.
D. C + H2O CO + H2.
Câu 24: Cho hình vẽ thí nghiệm phân tích định tính hợp chất hữu cơ C6H12O6:
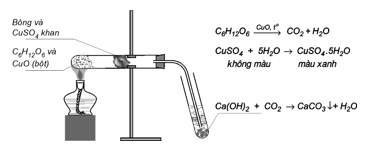
Hãy cho biết vai trò của bông và CuSO4 khan trong thí nghiệm trên?
A. Xác định sự có mặt của O.
B. Xác định sự có mặt của C và H.
C. Xác định sự có mặt của H.
D. Xác định sự có mặt của C.
Câu 25: Những hợp chất có thành phần phân tử hơn kém nhau một hoặc nhiều nhóm \( - \,C{H_2} - \) nhưng có tính chất hóa học tương tự nhau được gọi là:
A. Đồng đẳng.
B. Đồng phân.
C. Hiđrocacbon.
D. Thù hình.
Câu 26: Cho những chất sau: NaHCO3 (1); CH3COONa (2); H2C2O4 (3); CaC2 (4); Al4C3 (5); C2H5OH (6); C2H5Cl (7). Những chất hữu cơ là:
A. (1), (2), (4), (5).
B. (1), (4), (5) và (6).
C. (1), (3), (4), (5), (6) và (7).
D. (2), (3), (6) và (7).
Câu 27: Phân tích định lượng m gam hợp chất hữu cơ X thấy tỉ lệ khối lượng giữa 4 nguyên tố C, H, O, N là \[{m_C}:{\rm{ }}{m_H}:{\rm{ }}{m_O}:{\rm{ }}{m_N}\]= 4,8 : 1 : 6,4 : 2,8. Công thức đơn giản nhất của X là:
A. CH2ON.
B. C2 H6O2N.
C. C2 H5O2N.
D. C3 H4O2N
Câu 28: Đốt cháy hoàn toàn 3,72 gam chất hữu cơ A thu được 10,56 gam CO2 và 2,52 gam H2O; 0,448 lít N2 (đktc). Biết MA = 93 đvC. A có công thức phân tử là:
A. C3H7O2N.
B. C7H7N.
C. C6H7N.
D. C6H5ON.
Câu 29: Liên kết hóa học trong phân tử chất hữu cơ chủ yếu là liên kết
A. cộng hóa trị
B. ion
C. kim loại
D. hiđro.
Câu 30: Cặp chất nào sau đây là đồng phân của nhau?
A. C2H5OH, CH3OCH3.
B. CH3OCH3, CH3CHO.
C. CH3OH, C2H5OH.
D. CH3CH2Cl, CH3CH2OH.
--- Hết ---
Giám thị không giải thích thêm
Đề thi Hóa học lớp 11 Học kì 1 năm 2022 có ma trận (8 đề) - Đề 4
Phòng Giáo dục và Đào tạo ...
Đề thi Học kì 1
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 4)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: ..................................................................... Lớp: .............................
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; S = 32; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137)
Câu 1: Chất nào sau đây là hiđroxit lưỡng tính?
A. Mg(OH)2.
B. Fe(OH)3.
C. KOH.
D. Al(OH)3.
Câu 2: Phát biểu nào sau đây đúng?
A. Khi nồng độ mol của ion H+ trong dung dịch tăng thì giá trị pH của dung dịch giảm.
B. Sự điện li là sự hoà tan một chất vào nước thành dung dịch.
C. Sự điện li là quá trình oxi hóa - khử.
D. Theo A-rê-ni-ut, axit là chất khi tan trong nước có khả năng phân li ra anion OH-.
Câu 3: Dãy chỉ gồm chất điện li mạnh là:
A. HNO3, H2SO4, KOH, K2SiO3.
B. H2SO4, NaOH, Ag3PO4, HF.
C. HBr, Na2S, Mg(OH)2, Na2CO3.
D. Ca(OH)2, KOH, CH3COOH, NaCl.
Câu 4: Tính dẫn điện của các dung dịch axit, bazơ và muối là do:
A. chúng dễ hòa tan trong nước.
B. trong dung dịch chúng phân li ra các ion.
C. sự chuyển dịch của các phân tử hòa tan.
D. chúng ở trạng thái lỏng.
Câu 5: Dung dịch có pH = 7 là:
A. NH4Cl. B. CH3COONa.
C. C6H5ONa. D. KClO3.
Câu 6: Dung dịch X gồm: 0,09 mol \(C{l^ - }\), 0,04 mol Na+, a mol Fe3+ và b mol \(SO_4^{2 - }\). Khi cô cạn dung dịch X thu được 7,715 gam muối khan. Giá trị của a và b lần lượt là:
A. 0.05 và 0,05.
B. 0,03 và 0,02.
C. 0,07 và 0,08.
D. 0,018 và 0,027.
Câu 7: Chất nào sau đây không tạo kết tủa khi cho vào dung dịch AgNO3
A. KBr
B. K3PO4
C. HCl
D. H3PO4
Câu 8: pH của dung dịch Ba(OH)2 0,05M là:
A. 13
B. 12
C. 1
D. 11
Câu 9: Phản ứng hóa học nào sau đây có phương trình ion thu gọn là H+ + \(O{H^ - }\) → H2O?
A. HCl + NaOH → H2O + NaCl
B. NaOH + NaHCO3 → H2O + Na2CO3
C. H2SO4 + BaCl2 → 2HCl + BaSO4↓
D. H2SO4 + Ba(OH)2 → 2H2O + BaSO4↓
Câu 10: Các tập hợp ion sau đây có thể tồn tại đồng thời trong cùng một dung dịch?
A. Na+, Cu2+, \(O{H^ - }\), \(NO_3^ - \).
B. Ca2+, Fe2+, \(NO_3^ - \), \(C{l^ - }\).
C. Na+, Ca2+, \(HCO_3^ - \), \(O{H^ - }\).
D. Fe2+, H+, \(O{H^ - }\), \(NO_3^ - \).
Câu 11: Có thể thu được nitơ từ phản ứng nào sau đây?
A. Đun nóng dung dịch bão hòa natri nitrit với amoni clorua.
B. Nhiệt phân muối bạc nitrat.
C. Cho bột Cu vào dung dịch HNO3 đặc nóng.
D. Cho muối amoni nitrat vào dung dịch kiềm.
Câu 12: Tính oxi hóa của cacbon thể hiện ở phản ứng
A. C + O2 CO2.
B. C + 2CuO 2Cu + CO2.
C. 3C + 4Al Al4C3.
D. C + H2O CO + H2.
Câu 13: Nhận xét nào sau đây không đúng về muối amoni?
A. Muối amoni bền với nhiệt.
B. Các muối amoni đều là chất điện li mạnh.
C. Tất cả các muối amoni đều tan trong nước.
D. Các muối amoni đều bị thủy phân trong nước.
Câu 14: Một loại phân supephotphat kép có chứa 69,62% muối canxi đihiđrophotphat, còn lại gồm các chất không chứa photpho. Độ dinh dưỡng của loại phân lân này là:
A. 48,52% B. 39,76% C. 42,25% D. 45,75%
Câu 15: Khi nhiệt phân, nhóm các muối nitrat cho sản phẩm kim loại, khí NO2, O2 là
A. Cu(NO3)2, Pb(NO3)2.
B. Ca(NO3)2, Hg(NO3)2, AgNO3.
C. Zn(NO3)2, AgNO3, LiNO3.
D. Hg(NO3)2, AgNO3.
Câu 16: Trong các phản ứng sau, phản ứng nào HNO3 không đóng vai trò chất oxi hóa?
A. ZnS + HNO3 (đặc nóng)
B. Fe2O3 + HNO3 (đặc nóng)
C. FeSO4 + HNO3 (loãng)
D. Cu + HNO3 (đặc nóng)
Câu 17: Cho 30,6 gam hỗn hợp Cu, Fe, Zn tác dụng với dung dịch HNO3 loãng dư thu được dung dịch chứa 92,6 gam muối khan (không chứa muối amoni). Nung hỗn hợp muối đến khối lượng không đổi, thu được m gam rắn. Giá trị của m là
A. 38,6. B. 46,6.
C. 84,6. D. 76,6.
Câu 18: Dãy các chất đều phản ứng với NH3 trong điều kiện thích hợp là:
A. HCl, O2, Cl2, FeO.
B. H2SO4, Ba(OH)2, FeO, NaOH.
C. HCl, HNO3, AlCl3, CuO.
D. KOH, HNO3, CuO, CuCl2.
Câu 19: Điều chế NH3 từ hỗn hợp hồm N2 và H2 (tỉ lệ 1 : 3). Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,9. Hiệu suất phản ứng là:
A. 25%. B. 40%.
C. 10%. D. 20%.
Câu 20: Hoà tan hoàn toàn 0,9 g kim loại X vào dung dịch HNO3 thu được 0,28 lít khí N2O (đktc). Vậy X có thể là
A. Cu
B. Fe
C. Zn
D. Al
Câu 21: Cho photpho tác dụng với các chất sau: Ca, O2, Cl2, KClO3, HCl, HNO3 và H2SO4 đặc, nóng. Photpho tác dụng được với bao nhiêu chất trong số các chất trên?
A. 6. B. 5.
C. 4. D. 3.
Câu 22: Trong bình kín chứa 0,5 mol CO và m gam Fe3O4. Đun nóng bình cho tới khi phản ứng xảy ra hoàn toàn thì khí trong bình có tỉ khối so với khí CO ban đầu là 1,457. Giá trị của m là:
A. 17,4. B. 11,6.
C. 22,8. D. 23,2.
Câu 23: Khi đốt cháy than đá, thu được hỗn hợp khí trong đó có khí X (không màu, không mùi, độc). X là khí nào sau đây?
A. CO2. B. CO.
C. SO2. D. NO2.
Câu 24: Trong những dãy chất sau đây, dãy nào có các chất là đồng phân của nhau?
A. C2H5OH, CH3OCH3.
B. CH3OCH3, CH3CHO.
C. CH3CH2CH2OH, C2H5OH.
D. C4H10, C6H6.
Câu 25: Đốt cháy hoàn toàn 5,8 gam chất hữu cơ X bằng oxi thì thu được 6,72 lít CO2 (đktc) và 5,4 gam H2O. Biết rằng MX = 58. Công thức phân tử của X là
A. C4H10. B. C3H6O.
C. C2H4O2. D. C2H2O2.
Câu 26: Khi phân tích một hợp chất hữu cơ (X) có thành phần như sau: %C = 52,17%; %H = 13,04% và %O = 34,78%. Biết công thức đơn giản nhất trùng với công thức phân tử. Công thức phân tử của (X) là:
A. C2H6O. B. C3H8O.
C. CH4O. D. C4H10O.
Câu 27: Số liên kết σ và số liên kết π trong CH2 = CH – CH2 – CH = CH2 lần lượt là:
A. 8 và 2. B. 10 và 2.
C. 12 và 2. D. 10 và 4.
Câu 28: Thành phần các nguyên tố trong hợp chất hữu cơ
A. nhất thiết phải có cacbon, thường có H, hay gặp O, N sau đó đến halogen, S, P.
B. gồm có C, H và các nguyên tố khác.
C. bao gồm tất cả các nguyên tố trong bảng tuần hoàn.
D. thường có C, H hay gặp O, N, sau đó đến halogen, S, P.
Câu 29: Phản ứng hóa học của các hợp chất hữu cơ có đặc điểm là:
A. thường xảy ra rất nhanh và cho một sản phẩm duy nhất.
B. thường xảy ra chậm, không hoàn toàn, không theo một hướng nhất định.
C. thường xảy ra rất nhanh, không hoàn toàn, không theo một hướng nhất định.
D. thường xảy ra rất chậm, nhưng hoàn toàn, không theo một hướng xác định
Câu 30: Chất nào dưới đây là dẫn xuất của hiđrocacbon ?
A. NaCl B. CH2Cl2
C. CH3CH3. D. KBr.
--- Hết ---
Giám thị không giải thích thêm
Đề thi Hóa học lớp 11 Học kì 1 năm 2022 có ma trận (8 đề) - Đề 5
Phòng Giáo dục và Đào tạo ...
Đề thi Học kì 1
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 5)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: ..................................................................... Lớp: .............................
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; S = 32; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137)
Câu 1: Dãy các chất đều là chất điện li mạnh là
A. KOH, NaCl, H2CO3.
B. Na2S, Mg(OH)2 , HCl.
C. HClO, NaNO3, Ca(OH)2.
D. HCl, Fe(NO3)3, Ba(OH)2.
Câu 2: Một dung dịch chứa Mg2+ (0,02 mol), K+ (0,03 mol), Cl- (0,04 mol) và ion Z (y mol). Ion Z và giá trị của y là:
A. \(NO_3^ - \) (0,03).
B. \(CO_3^{2 - }\) (0,015).
C. \(SO_4^{2 - }\) (0,01).
D. \(NH_4^ + \) (0,01).
Câu 3: Dãy chất nào sau đây chỉ gồm các hiđroxit lưỡng tính?
A. Al(OH)3, Zn(OH)2, Fe(OH)2.
B. Zn(OH)2, Sn(OH)2, Pb(OH)2.
C. Al(OH)3, Fe(OH)2,Mg(OH)2.
D. Mg(OH), Pb(OH)2, Fe(OH)2.
Câu 4: Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong dung dịch?
A. AlCl3 và Na2CO3.
B. HNO3 và NaHCO3.
C. NaAlO2 và KOH.
D. NaCl và AgNO3.
Câu 5: Phản ứng hóa học nào sau đây có phương trình ion thu gọn là H+ + \(O{H^ - }\) → H2O?
A. HCl + NaOH → H2O + NaCl
B. NaOH + NaHCO3 → H2O + Na2CO3
C. H2SO4 + BaCl2 → 2HCl + BaSO4↓
D. H2SO4 + Ba(OH)2 → 2H2O + BaSO4↓
Câu 6: Cho 15 ml dung dịch HNO3 có pH = 2 trung hòa hết 10 ml dung dịch Ba(OH)2 có pH = a. Giá trị của a là:
A.13
B. 12,4
C.12,2
D.12,5
Câu 7: Phương trình điện li viết đúng là:
A. \(C{H_3}COOH \to C{H_3}CO{O^ - } + {H^ + }.\)
B. \({C_2}{H_5}OH \to {C_2}{H_5}^ + + O{H^ - }.\)
C. \(NaCl \to N{a^{2 + }} + C{l^{2 - }}.\)
D. \(Ba{(OH)_2} \to B{a^{2 + }} + 2O{H^ - }.\)
Câu 8: Khi hòa tan trong nước, chất nào sau đây làm cho quỳ tím chuyển màu xanh?
A. NaCl.
B. NH4Cl.
C. Na2CO3.
D. FeCl3.
Câu 9: Dãy gồm các ion có thể cùng tồn tại trong một dung dịch là
A. Ca2+, \(C{l^ - }\), Na+, \(CO_3^{2 - }\).
B. Al3+, \(SO_4^{2 - }\), \(C{l^ - }\), Ba2+.
C. Na+, \(O{H^ - }\), \(HCO_3^ - \), K+.
D. K+, Ba2+, \(O{H^ - }\), \(C{l^ - }\).
Câu 10: Dung dịch A có a mol \(NH_4^ + \), b mol Mg2+, c mol \(SO_4^{2 - }\) và d mol \(HSO_3^ - \). Biểu thức nào dưới đây biểu thị đúng sự liên quan giữa a, b, c, d?
A. a + 2b = c + d
B. a + 2b = 2c + d
C. a + b = 2c + d
D. a + b = c + d
Câu 11: Khí N2 tác dụng với dãy chất nào sau đây:
A. Li, CuO và O2.
B. Al, H2 và Mg.
C. NaOH, H2 và Cl2.
D. HI, O3 và Mg.
Câu 12: Muối được làm bột nở trong thực phẩm là
A. (NH4)2CO3.
B. Na2CO3.
C. NH4HSO3.
D. NH4Cl.
Câu 13: Cho các phát biểu sau:
(1) Độ dinh dưỡng của phân đạm, phân lân và phân kali tính theo phần trăm khối lượng tương ứng của N2O5; P2O5 và K2O.
(2) Người ta không bón phân urê kèm với vôi.
(3) Phân lân chứa nhiều photpho nhất là supephotphat kép.
(4) Bón nhiều phân đạm amoni sẽ làm đất chua.
(5) Quặng photphorit có thành phần chính là Ca3(PO4)2.
Trong các phát biểu trên, số phất biểu đúng là
A. 5.
B. 2.
C. 3.
D. 4.
Câu 14: Hoà tan hoàn toàn 12,8 gam Cu trong dung dịch HNO3 thấy thoát ra V lít hỗn hợp khí A gồm NO, NO2 (đktc). Biết tỉ khối hơi của A so với H2 là 19. Giá trị của V là:
A. 4,48 lít
B. 2,24 lít
C. 0,448 lít
D. Kết quả khác
Câu 15: Khi cho clo dư qua photpho nóng chảy, sẽ thu được sản phẩm nào sau đây:
A. PCl3
B. PCl5
C. PCl2
D. PCl
Câu 16: Tính khử của cacbon thể hiện trong phản ứng nào sau đây?
A. 2C + Ca CaC2.
B. C + 2H2 CH4.
C. C + CO2 2CO.
D. 3C + 4Al → Al4C3.
Câu 17: Một loại đá vôi chứa 80% CaCO3 còn lại là tạp chất trơ. Nung m gam đá này một thời gian thu được 0,78m gam chất rắn. Hiệu suất phân hủy CaCO3 là:
A. 78%.
B. 50%.
C. 62,5%.
D. 97,5%.
Câu 18: Để thu được muối photphat trung hòa, cần V ml dung dịch NaOH 1M cho tác dụng với 50 ml dung dịch H3PO4 0,5M. Giá trị của V là:
A. 75 ml.
B. 100 ml.
C. 50 ml.
D. 25 ml.
Câu 19: Khi đốt cháy than đá, thu được hỗn hợp khí trong đó có khí X (không màu, không mùi, độc). X là khí nào sau đây?
A. CO2. B. CO.
C. SO2. D. NO2.
Câu 20: Nhỏ dung dịch bạc nitrat vào dung dịch natri photphat đựng trong ống nghiệm thì xuất hiện kết tủa màu
A. trắng.
B. vàng.
C. đen.
D. nâu.
Câu 21: Hàm lượng KCl có trong một loại phân kali có độ dinh dưỡng 50% là
A. 79,26%.
B. 95.51%.
C. 31,54%.
D. 26,17%
Câu 22: Trong phòng thí nghiệm người ta điều chế HNO3 từ
A. NH3 và O2.
B. NaNO2 và H2SO4 đặc.
C. NaNO3 và H2SO4 đặc.
D. NaNO2 và HCl đặc.
Câu 23: Tính oxi hóa của cacbon thể hiện ở phản ứng
A. C + O2 CO2.
B. C + 2CuO 2Cu + CO2.
C. 3C + 4Al Al4C3.
D. C + H2O CO + H2.
Câu 24: Trong thành phần phân tử, hợp chất hữu cơ nhất thiết phải có nguyên tố:
A. cacbon
B. hiđro
C. oxi
D. nitơ.
Câu 25: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 54,54%; %mH = 9,09% còn lại là oxi. Tỉ khối hơi của X so với CO2 bằng 2. Công thức phân tử của X là:
A. C5H12O
B. C2H4O
C. C3H4O3
D. C4H8O2.
Câu 26: Cặp chất nào sau đây là đồng đẳng của nhau?
A. CH3OH, CH3OCH3.
B. CH3OCH3, CH3CHO.
C. CH3OH, C2H5OH.
D. CH3CH2OH, C3H6(OH)2.
Câu 27: Số công thức tạo mạch hở có thể có ứng với công thức phân tử C4H8 là:
A. 1 B. 2
C. 3 D. 4.
Câu 28: Phản ứng hóa học của các chất hữu cơ thường:
A. xảy ra nhanh và tạo ra hỗn hợp sản phẩm.
B. xảy ra chậm và tạo ra một sản phẩm duy nhất.
C. xảy ra chậm và tạo ra hỗn hợp sản phẩm.
D. xảy ra nhanh và tạo ra một sản phẩm duy nhất.
Câu 29: Đốt cháy hoàn toàn m gam hợp chất hữu cơ X (C, H, O). Cần vừa đủ 6,72 lít O2 (đktc), thu được 4,48 lít CO2 (đktc) và 5,4 gam H2O. Thành phần phần trăm khối lượng oxi trong X là
A. 34,78%
B. 69,56%
C. 76,19 %
D. 67,71%
Câu 30: Liên kết hóa học trong phân tử chất hữu cơ chủ yếu là liên kết
A. ion
B. cộng hóa trị
C. kim loại
D. hiđro.
--- Hết ---
Giám thị không giải thích thêm
Đề thi Hóa học lớp 11 Học kì 1 năm 2022 có ma trận (8 đề) - Đề 6
Phòng Giáo dục và Đào tạo ...
Đề thi Học kì 1
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 6)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: ..................................................................... Lớp: .............................
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; S = 32; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137)
Câu 1: Có 4 dung dịch: Natri clorua, rượu etylic, axit axetic, kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
A. NaCl < C2H5OH < CH3COOH < K2SO4.
B. C2H5OH < CH3COOH < NaCl < K2SO4.
C. C2H5OH < CH3COOH < K2SO4 < NaCl.
D. CH3COOH < NaCl < C2H5OH < K2SO4.
Câu 2: Trộn 400 ml dung dịch Fe2(SO4)3 0,2M với 100 ml dung dịch FeCl3 0,3M thu được dung dịch Y. Nồng độ ion Fe3+ trong Y là:
A. 0,38M.
B. 0,22M.
C. 0,19M.
D. 0,11M.
Câu 3: Dãy chất nào sau đây chỉ gồm các hiđroxit lưỡng tính?
A. Al(OH)3, Zn(OH)3, Fe(OH)2.
B. Zn(OH)2, Sn(OH)2, Pb(OH)2.
C. Al(OH)3, Fe(OH)2, Mg(OH)2.
D. Mg(OH), Pb(OH)2, Fe(OH)2.
Câu 4: Theo thuyết Areniut kết luận nào sau đây không đúng?
A. Muối là những hợp chất khi tan trong nước chỉ phân li ra cation kim loại và anion gốc axit.
B. Muối axit là muối mà anion gốc axit vẫn còn hiđrô có khả năng phân li ra ion H+.
C. Muối trung hòa là muối mà anion gốc axit không còn hiđrô có khả năng phân li ra H+.
D. Hiđroxit lưỡng tính khi tan vào nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
Câu 5: Cho 300 ml dung dịch chứa H2SO4 0,1M, HNO3 0,2M và HCl 0,3M tác dụng với V ml dung dịch NaOH 0,2 M và KOH 0,29M thu được dung dịch có pH = 2. Giá trị của V là:
A. 134.
B. 147.
C. 114.
D. 169.
Câu 6: Khi hòa tan trong nước, chất nào sau đây làm cho quỳ tím chuyển màu xanh?
A. NaCl.
B. NH4Cl.
C. Na2CO3.
D. FeCl3.
Câu 7: Hòa tan 4,9 gam H2SO4 vào nước thu được 1 lít dung dịch. pH của dung dịch thu được là:
A. 1
B. 2
C. 3
D. 4
Câu 8: Các ion nào sau không thể cùng tồn tại trong một dung dịch
A. Na+, Mg2+, \(NO_3^ - \), \(SO_4^{2 - }\).
B. Ba2+, Al3+, \(C{l^ - }\), \(HSO_4^ - \).
C. Cu2+, Fe3+, \(SO_4^{2 - }\), \(C{l^ - }\).
D. K+, \(NH_4^ + \), \(O{H^ - }\), \(PO_4^{3 - }\).
Câu 9: Phương trình ion rút gọn: H+ + \(HCO_3^ - \) → CO2 ↑ + H2O
Tương ứng với phương trình hóa học dạng phân tử nào sau đây?
(1) 2HCl + Na2CO3 → 2 NaCl + CO2 ↑ + H2O
(2) 2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 ↑ + 2H2O
(3) CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2O
(4) Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 ↑ + 2H2O
A. 1, 2
B. 2, 3
C. 2, 4
D. 1, 3
Câu 10: Cho các chất sau: HCl, HNO3, NaOH, Ba(OH)2, CH3COOH, K2SO4, Na3PO4, HF, Al2(SO4)3, H2SO3, H3PO4. Số chất điện li yếu là:
A. 2
B. 3
C. 4
D. 5
Câu 11: Cho các phản ứng sau:
(1) N2 + O2 2NO
(2) N2 + 3H2 2NH3.
Trong hai phản ứng trên thì nitơ:
A. chỉ thể hiện tính oxi hóa.
B. chỉ thể hiện tính khử.
C. thể hiện tính khử và tính oxi hóa.
D. không thể hiện tính khử và tính oxi hóa.
Câu 12: Cho 100 gam dung dịch NH4HSO4 có nồng độ 11,5% vào 100 gam dung dịch Ba(OH)2 có nồng độ 13,68% và đun nhẹ. Thể tích khí (đktc) và khối lượng kết tủa thu được là (giả sử toàn bộ khí sinh ra thoát ra khỏi dung dịch)
A. 2,24 lít và 23,3 gam
B. 2,244 lít và 18,64 gam
C. 1,344 lít và 18,64 gam
D. 1,792 lít và 18,64 gam.
Câu 14: Trong phòng thí nghiệm, người ta điều chế HNO3 từ
A. NH3 và O2.
B. NaNO2 và H2SO4 đặc.
C. NaNO3 và H2SO4 đặc.
D. NaNO2 và HCl đặc.
Câu 15: Trong các phản ứng sau, phản ứng nào HNO3 không đóng vai trò chất oxi hóa?
A. ZnS + HNO3 (đặc, nóng)
B. Fe2O3 + HNO3(đặc, nóng)
C. FeSO4 + HNO3 (loãng)
D. Cu + HNO3 (đặc, nóng)
Câu 16: Chia 20 gam hỗn hợp gồm Mg, Al, Zn thành hai phần bằng nhau. Đốt cháy hoàn toàn phần một trong O2 dư thu được 21 gam hỗn hợp oxit. Phần hai hòa tan trong dung dịch HNO3 đặc, nóng dư thu được V (lít) NO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của V là:
A. 44,8.
B. 89,6.
C. 22,4.
D. 30,8.
Câu 17: Thêm 0,15 mol KOH vào dung dịch chứa 0,1 mol H3PO4. Sau phản ứng trong dung dịch chứa:
A. KH2PO4 và K3PO4.
B. K2HPO4 và K3PO4.
C. KH2PO4 và K2HPO4.
D. K3PO4 và KOH dư.
Câu 18: Ở nhiệt độ cao, khí CO có thể khử được oxit nào sau đây?
A. MgO.
B. Fe2O3.
C. Al2O3.
D. BaO.
Câu 19: Phân lân đều cung cấp cho cây trồng nguyên tố dinh dưỡng là
A. Nitơ.
B. Cacbon.
C. Photpho.
D. Kali.
Câu 20: Đốt cháy một lượng nhỏ photpho đơn chất (P) trong bình chứa khí oxi dư thu được một oxit X. Công thức của X là
A. PO2.
B. P2O7.
C. P2O5.
D. P2O3.
Câu 21: Cho cacbon lần lượt tác dụng với Al, H2O, CuO, HNO3 đặc, H2SO4 đặc, KClO3, CO2 ở điều kiện thích hợp. Số phản ứng mà trong đó cacbon đóng vai trò chất khử là:
A. 6.
B. 4.
C. 7.
D. 5.
Câu 22: Tủ lạnh dùng lâu ngày thường có mùi hôi. Để khử mùi người ta thường cho vào tủ lạnh một mẩu than gỗ. Than gỗ lại có khả năng khử mùi hôi là vì:
A. than gỗ có tính khử mạnh.
B. than gỗ xúc tác cho quá trình chuyển hóa các chất khí có mùi hôi thành chất không mùi.
C. than gỗ có khả năng phản ứng với các khí có mùi tạo thành chất không mùi.
D. than gỗ có khả năng hấp phụ các khí có mùi hôi.
Câu 23: Chất nào sau đây có thể làm khô khí NH3 có lẫn hơi nước?
A. P2O5.
B. H2SO4 đặc.
C. CuO bột.
D. NaOH rắn.
Câu 24: Số công thức tạo mạch hở có thể có ứng với công thức phân tử C4H8 là:
A. 1
B. 2
C. 3
D. 4.
Câu 25: Cặp chất nào sau đây là đồng đẳng của nhau?
A. CH3OH, CH3OCH3.
B. CH3OCH3, CH3CHO.
C. CH3OH, C2H5OH.
D. CH3CH2OH, C3H6(OH)2.
Câu 26: Chất nào dưới đây là dẫn xuất của hiđrocacbon ?
A. NaCl
B. CH2Cl2
C.CH3CH3.
D. KBr.
Câu 27: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 60,0%; %mH = 8,0%, còn lại là oxi. Tỉ khối hơi của X so với CO2 nhỏ hơn 3. Công thức phân tử của X là:
A. C3H8O
B. C3H8O2
C. C5H8O2
D. C5H8O.
Câu 28: Thành phần các nguyên tố trong hợp chất hữu cơ:
A. nhất thiết phải có cacbon, thường có H, hay gặp O, N sau đó đến halogen, S, P.
B. gồm có C, H và các nguyên tố khác.
C. bao gồm tất cả các nguyên tố trong bảng tuần hoàn.
D. thường có C, H hay gặp O, N, sau đó đến halogen, S, P.
Câu 29: Phản ứng hóa học của các hợp chất hữu cơ có đặc điểm là:
A. thường xảy ra rất nhanh và cho một sản phẩm duy nhất.
B. thường xảy ra chậm, không hoàn toàn, không theo một hướng nhất định.
C. thường xảy ra rất nhanh, không hoàn toàn, không theo một hướng nhất định.
D. thường xảy ra rất chậm, nhưng hoàn toàn, không theo một hướng xác định.
Câu 30: Đốt cháy hoàn toàn 5,8 gam chất hữu cơ X bằng oxi thì thu được 6,72 lít CO2 (đktc) và 5,4 gam H2O. Biết rằng MX = 58. Công thức phân tử của X là
A. C4H10.
B. C3H6O.
C. C2H4O2.
D. C2H2O2.
--- Hết ---
Giám thị không giải thích thêm
Đề thi Hóa học lớp 11 Học kì 1 năm 2022 có ma trận (8 đề) - Đề 7
Phòng Giáo dục và Đào tạo ...
Đề thi Học kì 1
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 7)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: ................................................................... Lớp: ............................
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; S = 32; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137)
Câu 1: Ứng dụng phổ biến nhất của amoni nitrat là làm phân bón, thuốc nổ quân sự. Amoni nitrat có công thức hóa học là
A. NH4NO2.
B. (NH4)2NO3.
C. NH4NO3.
D. (NH4)2NO2.
Câu 2: Phản ứng NaOH + HNO3 → NaNO3 + H2O có phương trình ion thu gọn là: A. H+ + OH- → H2O.
B. Na+ + \(NO_3^ - \)→ NaNO3.
C. H2+ + OH2- → H2O.
D. Na+ + \(NO_3^{2 - }\)→ NaNO3.
Câu 3: Chất bột X màu đen, có khả năng hấp phụ các khí độc nên được dùng trong nhiều loại mặt nạ phòng độc. Chất X là
A. silicagen.
B. than hoạt tính.
C. thạch anh.
D. đá vôi.
Câu 4: Không nên bón phân urê cho cây trồng cùng lúc với:
A. phân vi lượng.
B. phân kali.
C. vôi sống.
D. phân lân.
Câu 5: Thực hiện thí nghiệm như hình vẽ dưới đây:
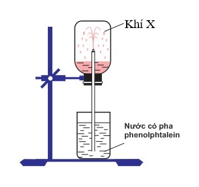
Bên trong bình, lúc đầu có chứa khí X. Hiện tượng xảy ra khi tiến hành thí nghiệm: nước phun mạnh vào bình và chuyển thành màu hồng. Khí X là
A. NH3. B. HCl.
C. CO2. D. N2.
Câu 6: Dung dịch HNO3 0,01M có pH bằng:
A. 13. B. 1.
C. 12. D. 2.
Câu 7: Dung dịch X gồm 0,05 mol Na+, 0,04 mol Cl-, 0,03 mol \(SO_4^{2 - }\) và Mg2+. Cô cạn dung dịch X, thu được m gam chất rắn khan. Giá trị của m là:
A. 6,820. B. 5,690.
C. 8,875. D. 6,050.
Câu 8: Một loại nước thải công nghiệp có pH = 3,5. Nước thải đó có môi trường:
A. trung tính.
B. axit.
C. bazơ.
D. lưỡng tính.
Câu 9: Hoà tan hoàn toàn m gam Al vào dung dịch HNO3 loãng, thu được dung dịch Y chứa 8m gam muối và x mol một chất khí duy nhất là N2O. Cho dung dịch NaOH dư vào Y, kết thúc thí nghiệm có 25,84 gam NaOH đã phản ứng. Giá trị của x gần nhất với
A. 0,060. B. 0,050.
C. 0,030. D. 0,055.
Câu 10: Cặp chất nào sau đây là đồng đẳng của nhau?
A. CH3OH, CH3OCH3.
B. CH3OCH3, CH3CHO.
C. CH3OH, C2H5OH.
D. CH3CH2OH, C3H6(OH)2.
Câu 11: Trong công nghiệp, axit nitric được tổng hợp từ amoniac qua ba giai đoạn với hiệu suất của toàn bộ quá trình đạt 96%. Theo quá trình trên, từ 4 tấn amoniac người ta thu được m tấn dung dịch HNO3 60%. Giá trị của m là
A. 24,71. B. 23,72.
C. 25,74. D. 14,82.
Câu 12: Silic tan được trong dung dịch của chất nào sau đây?
A. NaOH. B. HF.
C. NaCl. D. HCl.
Câu 13: Chất nào sau đây là chất điện li?
A. C2H5OH.
B. HNO3.
C. C12H22O11.
D. CO2.
Câu 14: Số công thức cấu tạo mạch hở có thể có ứng với các công thức phân tử C2H4O là
A. 3 B. 2
C. 1 D. 4.
Câu 15: Nhỏ từ từ dung dịch HCl đến dư vào dung dịch NaHCO3, hiện tượng xảy ra là
A. có kết tủa và sủi bọt khí.
B. thoát ra khí không màu.
C. thoát ra khí mùi khai.
D. xuất hiện kết tủa trắng.
Câu 16: Đốt cháy hoàn toàn 8,8 gam hợp chất hữu cơ X (C, H, O), thu được 8,96 lít CO2 (đktc) và 7,2 gam H2O. Biết tỉ khối của X so với CO2 là 2. Công thức phân tử của X là
A. C2H4O
B. C5H12O
C. C4H8O2
D. C3H4O3.
Câu 17: Cặp chất nào sau đây là đồng phân của nhau?
A. C2H5OH, CH3OCH3
B. CH3OCH3, CH3CHO.
C. CH3OH, C2H5OH
D. CH3CH2Cl, CH3CH2OH
Câu 18: Cho 0,003 mol H3PO4 tác dụng vừa đủ với 30 ml dung dịch NaOH nồng độ a mol/lít, thu được 0,003 mol muối trung hòa. Giá trị của a là
A. 0,03. B. 0,10.
C. 0,01. D. 0,30.
Câu 19: Dung dịch X chứa 0,2 mol Ca2+; 0,1 mol Ba2+; 0,2 mol \(C{l^ - }\) và a mol \(HCO_3^ - \). Đun dung dịch X đến cạn thu được hỗn hợp muối khan có khối lượng là:
A. 53,2 gam.
B. 40,8 gam.
C. 39,7 gam.
D. 37,4 gam.
Câu 20: Chất nào sau đây là hiđrocacbon?
A. CH2O
B. C2H5Br
C. C6H6
D. CH3COOH.
Câu 21: Trong phản ứng hóa học nào sau đây cacbon chỉ thể hiện tính khử?
A. C + O2 CO2.
B. C + 2H2 CH4.
C. 3C + CaO CaC2 + CO.
D. 3C + 4Al Al4C3.
Câu 22: Cho 2,4 gam Mg tác dụng hoàn toàn với dung dịch HNO3 (dư), thu được 0,448 lít khí X (sản phẩm khử duy nhất của \(\mathop N\limits^{ + 5} \), ở đktc). Khí X là
A. N2O.
B. NO2.
C. N2.
D. NO.
Câu 23: Sản phẩm của phản ứng nhiệt phân Cu(NO3)2 là
A. CuO, NO2, O2.
B. Cu, NO, O2.
C. Cu, NO2, O2.
D. CuO, NO, O2.
Câu 24: Các loại phân lân đều cung cấp cho cây trồng nguyên tố:
A. cacbon. B. kali.
C. nitơ. D. photpho.
Câu 25: Chất nào sau đây là muối trung hòa?
A. Na2HPO4.
B. NaHSO4.
C. KHCO3.
D. Na2SO4.
Câu 26: Liên kết hóa học trong phân tử chất hữu cơ chủ yếu là liên kết:
A. cộng hóa trị
B. ion
C. kim loại
D. hiđro.
Câu 27: Trong thành phần phân tử hợp chất hữu cơ nhất thiết phải có nguyên tố nào?
A. Cacbon B. Hiđro
C. Oxi D. Nitơ.
Câu 28: Đốt cháy hết m gam than (C) trong V lít oxi thu được 2,24 lít hỗn hợp X gồm 2 khí. Tỉ khối của X so với oxi bằng 1,25. Các thể tích đo được (đktc). Giá trị của m là
A. 1,2 và 1,96.
B. 1,5 và 1,792.
C. 1,2 và 2,016.
D. 1,5 và 2,8.
--- Hết ---
Giám thị không giải thích thêm
Đề thi Hóa học lớp 11 Học kì 1 năm 2022 có ma trận (8 đề) - Đề 8
Phòng Giáo dục và Đào tạo ...
Đề thi Học kì 1
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 8)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: ................................................................... Lớp: ............................
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; S = 32; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137)
Câu 1: Trộn 400 ml dung dịch Fe2(SO4)3 0,2M với 100 ml dung dịch FeCl3 0,3m thu được dung dịch Y. Nồng độ ion Fe3+ trong Y là
A. 0.38M. B. 0,22M.
C. 0,19M. D. 0,11M.
Câu 2: Cho các dung dịch HCl, H2SO4 và CH3COOH có cùng giá trị pH. Sự sắp xếp nào sau đây đúng với giá trị nồng độ mol của các dung dịch trên?
A. HCl < H2SO4 < CH3COOH
B. H2SO4 < HCl < CH3COOH
C. H2SO4 < CH3COOH < HCl
D. CH3COOH < HCl < H2SO4
Câu 3: Phản ứng hóa học nào sau đây có phương trình ion thu gọn là H+ + OH- → H2O?
A. HCl + NaOH → H2O + NaCl
B. NaOH + NaHCO3 → H2O + Na2CO3
C. H2SO4 + BaCl2 → 2HCl + BaSO4
D. H2SO4 + Ba(OH)2 → 2H2O + BaSO4
Câu 4: Phương trình ion rút gọn của phản ứng cho biết
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Câu 5: Số công thức tạo mạch hở có thể có ứng với công thức phân tử C4H8 là:
A. 1 B. 2
C. 3 D. 4.
Câu 6: Cho cacbon lần lượt tác dụng với Al, H2O, CuO, HNO3 đặc, H2SO4 đặc, KClO3, CO2 ở điều kiện thích hợp. Số phản ứng mà trong đó cacbon đóng vai trò chất khử là
A. 6. B. 4.
C. 7. D. 5.
Câu 7: Dung dịch X gồm: 0,09 mol Cl-, 0,04 mol Na+, a mol Fe3+ và b mol \(SO_4^{2 - }\). Khi cô cạn X thu được 7,715 gam muối khan. Giá trị của a và b lần lượt là:
A. 0,05 và 0,05.
B. 0,03 và 0,02.
C. 0,07 và 0,08.
D. 0,018 và 0,027.
Câu 8: Cho các dung dịch axit có cùng nồng độ mol: H2S, HCl, H2SO4, H3PO4, dung dịch có nồng độ H lớn nhất là:
A. H2SO4 B. H2S
C. HCl D. H3PO4
Câu 9: Cho 10 ml dung dịch X chứa HCl 1M và H2SO4 0,5M. thể tích dung dịch NaOH 1M cần đẻ trung hòa dung dịch X là
A. 10 ml. B. 15 ml.
C. 20 ml. D. 25 ml.
Câu 10: Trong thành phần phân tử hợp chất hữu cơ nhất thiết phải có nguyên tố
A. cacbon
B. hiđro
C. oxi
D. nitơ.
Câu 11: Đốt cháy hết m gam than (C) trong V lít oxi thu được 2,24 lít hỗn hợp X gồm 2 khí. Tỉ khối của X so với oxi bằng 1,25. Các thể tích đo được (đktc). Giá trị của m là
A. 1,2 và 1,96.
B. 1,5 và 1,792.
C. 1,2 và 2,016.
D. 1,5 và 2,8.
Câu 12: Đốt cháy hoàn toàn 7,4 gam hợp chất hữu cơ X (C, H, O). Thu được 6,72 lít CO2 (đktc) và 5,4 gam H2O. Khi hóa hơi 1,85 gam X, thu được thể tích bằng với thể tích của 0,7 gam N2 cùng nhiệt độ, áp suất. Xác định công thức phân tử của X.
A. C5H10O B. C3H6O2 C. C2H2O3 D. C3H6O.
Câu 13: Phản ứng hóa học của các chất hữu cơ thường:
A. xảy ra nhanh và tạo ra hỗn hợp sản phẩm.
B. xảy ra chậm và tạo ra một sản phẩm duy nhất.
C. xảy ra chậm và tạo ra hỗn hợp sản phẩm.
D. xảy ra nhanh và tạo ra một sản phẩm duy nhất.
Câu 14: Nhiệt phân hết 4,84 gam X gồm KHCO3 và NaHCO3 đến phản ứng hoàn toàn được 0,56 lít khí (đktc). Tìm phần trăm khối lượng của NaHCO3 trong X:
A. 16,02% B. 17,36%
C. 18,00% D. 14,52%
Câu 15: Nitơ thể hiện tính khử trong phản ứng với chất nào sau đây?
A. H2.
B. O2.
C. Mg.
D. Al.
Câu 16: X là muối khi tác dụng với dung dịch NaOH dư sinh khí mùi khai, tác dụng với dung dịch BaCl2 sinh kết tủa trắng không tan trong HNO3. X là muối nào trong số các muối sau?
A. (NH4)2CO3.
B. (NH4)2SO3.
C. NH4HSO3.
D. (NH4)3PO4.
Câu 17: Trong phòng thí nghiệm người ta điều chế HNO3 từ:
A. NH3 và O2
B. NaNO2 và H2SO4 đặc.
C. NaNO3 và H2SO4 đặc.
D. NaNO2 và HCl đặc.
Câu 18: Đặc điểm chung của hợp chất hữu cơ là:
A. tan trong nước, không tan trong dung môi hữu cơ.
B. nhiệt độ nóng chảy, nhiệt độ sôi cao.
C. liên kết trong phân tử chủ yếu là liên kết ion.
D. thường kém bền với nhiệt và dễ cháy.
Câu 19: Nhiệt phân hoàn toàn Fe(NO3)2 trong không khí thu được sản phẩm gồm:
A. FeO, NO2, O2.
B. Fe2O3, NO2.
C. Fe, NO2, O2.
D. Fe2O3, NO2, O2.
Câu 20: Tỉ khối hơi cuả chất X so với hiđro bằng 44. Phân tử khối của X là:
A. 44 B. 46 C. 22 D. 88.
Câu 21: Nhận định nào sau đây là sai?
A. HNO3 phản ứng với tất cả bazơ.
B. HNO3 (loãng, đặc, nóng) phản ứng với hầu hết kim loại trừ Au, Pt.
C. Tất cả các muối amoni khi nhiệt phân đều tạo khí amoniac.
D. Hỗn hợp muối nitrat và hợp chất hữu cơ nóng chảy có thể bốc cháy.
Câu 22: Trong phòng thí nghiệm có thể điều chế N2 bằng cách:
A. nhiệt phân NaNO2.
B. đun hỗn hợp NaNO2 và NH4Cl.
C. thủy phân Mg3N2.
D. phân hủy khí NH3.
Câu 23: Nung một lượng NH3 trong bình kín. Sau một thời gian đưa về nhiệt độ ban đầu thấy áp suất khí trong bình tăng 1,5 lần so với áp suất ban đầu. Tỉ lệ NH3 bị phân hủy là:
A. 25%. B. 33%.
C. 50%. D. 67%.
Câu 24: Cho 3 gam Al phản ứng vừa đủ với dung dịch chứa 28 gam HNO3 thu được khí X và dung dịch không chứa NH4NO3. Khí X là
A. N2.
B. N2O.
C. NO.
D. NO2.
Câu 25: Nung 2,23 gam hỗn hợp X gồm các kim loại Fe, Al, Zn, Mg trong oxi, sau một thời gian thu được 2,71 gam hỗn hợp Y. Hòa tan hoàn toàn Y vào dung dịch HNO3 dư, thu được 0,672 lít khí NO (sản phẩm khử duy nhất, (đktc)). Số mol HNO3 đã phản ứng là:
A. 0,18. B. 0,15.
C. 0,16. D. 0,12.
Câu 26: Tìm phương trình hóa học viết sai.
A. 2P + 3Ca Ca3P2
B. 4P + 5O2 (dư) 2P2O5
C. PCl3 + 3H2O → H3PO3 + 3HCl
D. P2O3 + 3H2O 2H3PO4
Câu 27: Loại phân đạm nào sau đây có độ dinh dưỡng cao nhất?
A. (NH4)2SO4.
B. (NH2)2CO.
C. NH4NO3.
D. NH4Cl.
Câu 28: Dãy các chất đều là chất điện li mạnh là:
A. KOH, NaCl, H2CO3.
B. Na2S, Mg(OH)2 , HCl.
C. HClO, NaNO3, Ca(OH)2.
D. HCl, Fe(NO3)3, Ba(OH)2.
Câu 29: Cho a mol P2O5 vào 200 ml dung dịch NaOH 2,75M thì thu được dung dịch chứa b mol NaH2PO4 và 0,15 mol Na2HPO4. Giá trị của a và b là
A. a = 0,2 và b = 0,25.
B. a = 0,4 và b = 0,25.
C. a = 0,4 và b = 0,5.
D. a = 0,2 và b = 0,5.
Câu 30: Kết quả phân tích nguyên tố hợp chất X cho biết %mc = 54,54%; %mH = 9,09% còn lại là oxi. Tỉ khối hơi của X so với CO2 bằng 2. Công thức phân tử của X là
A. C5H12O B. C2H4O
C. C3H4O3 D. C4H8O2.
--- Hết ---
Giám thị không giải thích thêm