Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh bộ câu hỏi trắc nghiệm Hóa học lớp 8 Bài 31: Tính chất - Ứng dụng của hiđro có đáp án chi tiết, chọn lọc. Tài liệu có 4 trang gồm 23 câu hỏi trắc nghiệm cực hay bám sát chương trình sgk Hóa học 8. Hi vọng với bộ câu hỏi trắc nghiệm Tính chất - Ứng dụng của hiđro có đáp án này sẽ giúp bạn ôn luyện kiến thức để đạt kết quả cao trong bài thi môn Hóa học 8 sắp tới.
Giới thiệu về tài liệu:
- Số trang: 4 trang
- Số câu hỏi trắc nghiệm: 23 câu
- Lời giải & đáp án: có
Mời quí bạn đọc tải xuống để xem đầy đủ tài liệu Trắc nghiệm Tính chất - Ứng dụng của hiđro có đáp án – Hóa học lớp 8:

Trắc nghiệm Hóa học 8
Bài 31: Tính chất - Ứng dụng của hiđro
Câu 1: Ở điều kiện thường, hiđro là chất ở trạng thái nào?
A. Rắn.
B. Lỏng.
C. Khí.
D. hợp chất rắn.
Lời giải:
điều kiện thường, hiđro là chất ở trạng thái khí.
Đáp án cần chọn là: C
Câu 2: Tính chất vật lí nào dưới đây không phải của hiđro?
A. Là chất khí không màu, không mùi, không vị.
B. Tan ít trong nước.
C. Tan nhiều trong nước.
D. Nhẹ hơn không khí
Lời giải:
Tính chất vật lí không phải của hiđro là: Tan nhiều trong nước.
Đáp án cần chọn là: C
Câu 3: Hai thể tích khí H2 với một thể tích khí nào sau đây tạo thành hỗn hợp nổ?
A. Clo.
B. Oxi.
C. Nitơ.
D. Cacbon đioxit.
Lời giải:
Hai thể tích khí H2 với một thể tích khí O2 tạo thành hỗn hợp nổ.
Đáp án cần chọn là: B
Câu 4: Chất rắn Cu tạo thành từ phản ứng của CuO và H2 có màu gì?
A. Màu đen.
B. Màu nâu.
C. Màu xanh.
D. Màu đỏ.
Lời giải:
H2 tác dụng với CuO ở nhiệt độ cao sinh ra Cu:
PTHH: H2 + CuO 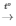 Cu + H2O
Cu + H2O
Kim loại Cu tạo ra có màu đỏ.
Đáp án cần chọn là: D
Câu 5: Ứng dụng của hiđro là
A. Oxi hóa kim loại
B. Làm nguyên liệu sản xuất NH3, HCl, chất hữu cơ
C. Tạo hiệu ứng nhà kính
D. Tạo mưa axit
Lời giải:
Ứng dụng của hiđro là : Làm nguyên liệu sản xuất NH3, HCl, chất hữu cơ
Đáp án cần chọn là: B
Câu 6: Khí nhẹ nhất trong các khí sau:
A. H2
B. H2O
C. O2
D. CO2
Lời giải:
Ta có:MH2=2;MH2O=2+16=18;MO2=2.16=3;MCO2=12+16.2=44
Khí nhẹ nhất là khí có khối lượng phân tử nhỏ nhất => H2
Đáp án cần chọn là: A
Câu 7: Sau phản ứng của CuO và H2 thì có hiện tượng gì:
A. Sau phản ứng, chất rắn màu đen chuyển thành xanh lam
B. Sau phản ứng, chất rắn màu đen chuyển thành đỏ
C. Có chất khí bay lên
D. Không có hiện tượng
Lời giải:
Phản ứng: CuO + H2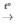 Cu + H2O
Cu + H2O
Chất rắn ban đầu là CuO có màu đen, sau phản ứng chuyển thành Cu có màu đỏ
Đáp án cần chọn là: B
Câu 8: Trong những oxit sau: CuO, MgO, Fe2O3, CaO, Na2O. Oxit nào không bị hiđro khử?
A. CuO, MgO
B. Fe2O3, Na2O
C. Fe2O3, CaO
D. CaO, Na2O, MgO
Lời giải:
Những oxit không bị hiđro khử là: CaO, Na2O, MgO
Đáp án cần chọn là: D
Câu 9: Trong những oxit sau: CuO, MgO, Al2O3, Ag2O, Na2O, PbO. Có bao nhiêu oxit phản ứng với hiđro ở nhiệt độ cao?
A. 4
B. 5
C. 3
D. 1
Lời giải:
- H2 không tác dụng với các oxit: Na2O, K2O, BaO, CaO, MgO, Al2O3
=> Những oxit phản ứng với hiđro ở nhiệt độ cao là: CuO, Ag2O, PbO
Đáp án cần chọn là: C
Câu 10: Tính thể tích hiđro (đktc) để điều chế 5,6 (g) Fe từ FeO?
A. 2,24 lít.
B. 1,12 lít.
C. 3,36 lít.
D. 4,48 lít.
Lời giải:
nFe= 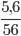 = 0,1(mol)
= 0,1(mol)
PTHH: FeO + H2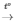 Fe + H2O
Fe + H2O
Tỉ lệ PT: 1mol 1mol
Phản ứng: 0,1mol ← 0,1mol
⇒VH2=0,1.22,4=2,24(l)
Đáp án cần chọn là: A
Câu 11: Đốt cháy 2,8 lít H2 (đktc) sinh ra H2O
A. 1,4 lít.
B. 2,8 lít.
C. 5,6 lít.
D. 2,24 lít.
Lời giải:
Số mol khí hiđro là:nH2 = 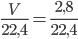 = 0,125mol
= 0,125mol
PTHH: 2H2 + O2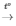 2H2O
2H2O
Tỉ lệ PT: 2mol 1mol 2mol
P/ứng: 0,125mol → 0,0625mol→ 0,125mol
=> Thể tích khí oxi là: VO2=22,4.n=22,4.0,0625=1,4 lít
Đáp án cần chọn là: A
Câu 12: Cho 8 gam CuO tác dụng với 1,12 lít khí H2 ở nhiệt độ cao. Sau phản ứng thấy có m gam chất rắn. Giá trị của m là
A. 0,64
B. 6,4
C. 0,72
D. 7,2
Lời giải:
Số mol CuO là: nCuO = 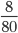 = 0,1mol
= 0,1mol
Số mol khí H2 là:nH2 = 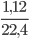 = 0,05mol
= 0,05mol
PTHH: CuO + H2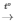 Cu + H2O
Cu + H2O
Vì đầu bài cho số mol 2 chất phản ứng => Xét tỉ lệ dư thừa
Ta có: 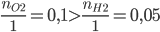 => CuO còn dư, H2 phản ứng hết
=> CuO còn dư, H2 phản ứng hết
=> tính toán theo H2
Vì CuO còn dư nên chất rắn thu được sau phản ứng gồm Cu sinh ra và CuO dư
PTHH: CuO + H2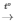 Cu + H2O
Cu + H2O
Tỉ lệ PT: 1mol 1mol 1 mol
P/ứng: 0,05mol ← 0,05mol → 0,05mol
=> Khối lượng Cu sinh ra là: mCu = 0,05.64 = 3,2 gam
Khối lượng CuO phản ứng là: mCuO phản ứng = 0,05.80 = 4 gam
=> Khối lượng CuO dư là: mCuO dư = mCuO ban đầu – mCuO phản ứng = 8 – 4 = 4 gam
=> Khối lượng chất rắn thu được sau phản ứng là
mchất rắn = mCu sinh ra + mCuO dư = 3,2 + 4 = 7,2 gam
Đáp án cần chọn là: D
Câu 13: Khử hoàn toàn 8 gam một oxit của kim loại R (có hoá trị II) cần vừa đủ 2,24 lít H2 (đktc). Kim loại R là:
A. Cu.
B. Mg.
C. Zn.
D. Fe.
Lời giải:
Gọi công thức của oxit là RO
PTHH: RO + H2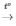 R + H2O
R + H2O
nH2= 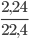 = 0,1(mol)
= 0,1(mol)
Theo PTHH: nRO = nH2 = 0,1 (mol)
=> (R + 16).0,1 = 8
=> R + 16 = 80
=> R = 64 (Cu)
Đáp án cần chọn là: A
Câu 14: Trong những oxit sau: CuO, MgO, Fe2O3, CaO, Na2O. oxit nào không bị Hidro khử:
A. CuO, MgO
B. Fe2O3, Na2O
C. Fe2O3, CaO
D. CaO, Na2O, MgO
Đáp án: D
Câu 15: Tỉ lệ mol của Hidro và Oxi sẽ gây nổ mạnh là:
A. 2:1
B. 1:3
C. 1:1
D. 1:2
Đáp án: A
Câu 16: Trong những oxit sau: CuO, MgO, Al2O3, AgO, Na2O, PbO. Có bao nhiêu oxit phản ứng với Hidro ở nhiệt độ cao:
A. 4
B. 5
C. 3
D. 1
Đáp án: C
Câu 17: Sau phản ứng của CuO và H2 thì có hiện tượng gì:
A. Sau phản ứng, chất rắn màu đen chuyển thành xanh lam
B. Sau phản ứng, chất rắn màu đen chuyển thành đỏ
C. Có chất khí bay lên
D. Không có hiện tượng
Đáp án: B
Câu 18: Sản phẩm thu được sau khi nung Chì (II) oxit trong Hidro
A. Pb
B. H2
C. PbO
D. Không phản ứng
Đáp án: A
PbO + H2 −to→ Pb + H2O
Câu 19: Tính chất nào sau đây không có ở Hidro
A. Nặng hơn không khí
B. Nhẹ nhất trong các chất khí
C. Không màu
D. Tan rất ít trong nước
Đáp án: A
Câu 20: Ứng dụng của Hidro
A. Oxi hóa kim loại
B. Làm nguyên liệu sản xuất NH3, HCl, chất hữu cơ
C. Tạo hiệu ứng nhà kinh
D. Tạo mưa axit
Đáp án: B
Câu 21: Khí nhẹ nhất trong các khí sau:
A. H2
B. H2O
C. O2
D. CO2
Đáp án: A
Câu 22: Công thức hóa học của hidro:
A. H2O
B. H
C. H2
D. H3
Đáp án: C
Câu 23: Cho 8g CuO tác dụng với H2 ở nhiệt độ cao. Sau phản ứng thấy có m (g) chất rắn. Tính m, chất rắn đó là chất nào?
A. Cu, m = 0,64g
B. Cu, m = 6,4g
C. CuO dư, m = 4g
D. Không xác định được
Đáp án: B
PTHH: CuO + H2 −to→ Cu + H2O
→ Chất rắn là Cu
Ta thấy: nCuO = ncu = 0,1 (mol)
→ mCu = n.M = 0,1 .64 = 6,4 (g)
Bài giảng Hóa học 8 Bài 31: Tính chất ứng dụng cảu Hiđro