Tailieumoi.vn giới thiệu Giải bài tập Hóa học 8 Bài 31: Tính chất - Ứng dụng của hiđro, chi tiết nhất giúp học sinh dễ dàng làm bài tập Tính chất - Ứng dụng của hiđro lớp 8.
a. Sắt (III) oxit
b. Thủy ngân (II) oxit
c. Chì (II) oxit.
Lời giải:Phương trình phản ứng:
Fe2O3 + 3H2 2Fe + 3H2O
HgO + H2 Hg + H2O
PbO + H2 Pb + H2O
Khí hiđro có nhiều ứng dụng, chủ yếu do tính chất rất nhẹ, do tính khử và khi cháy tỏa nhiều nhiệt
1. Dùng làm nhiên liệu cho động cơ tên lửa, có thể làm nhiên liệu cho động cơ ô tô thay cho xăng, dùng trong đèn xì oxi - hiđro để hàn cắt kim loại. Đó là vì khí hiđro cháy, sinh ra một lượng nhiệt lớn hơn nhiều lần so với cùng lượng nhiên liệu khác.
2. Là nguồn nguyên liệu trong sản xuất amoniac, axit và nhiều hợp chất hữu cơ.
3. Dùng làm chất khử để điều chế một số kim loại từ oxit của chúng.
4. Hiđro được dùng để bơm vào khinh khí cầu, bóng thám không vì là khí nhẹ nhất.
- Trong các chất khí, hiđro là khí…………Khí hiđro có……………..
- Trong phản ứng giữa H2 và CuO, H2 là………….vì…………của chất khác; CuO có…………vì ………cho chất khác.
- Trong các chất khí, hiđro là khí nhẹ nhất. Khí hiđro có tính khử.
- Trong phản ứng giữa H2 và CuO, H2 là chất khử vì chiếm oxi của chất khác; CuO có tính oxi hóa vì nhường oxi cho chất khác.
a. Tính số gam đồng kim loại thu được;
b. tính thể tích khí hiđro (đktc) cần dùng.
Lời giải:a. M = 64 + 16 = 80 (g/mol)
Số mol đồng (II) oxit: n == 0,6 (mol)
Phương trình phản ứng:
CuO + H2 H2O + Cu
1 1 1 (mol)
0,6 0,6 0,6 (mol)
Khối lượng đồng kim loại thu được:
m = n.M = 0,6.64 = 38,4 (g)
b. Thể tích khí hiđro cần dùng ở đktc là:
V = 22,4.n = 22,4.0,6 = 13,44 (lít).
a. Tính số gam thủy ngân thu được;
b. Tính số mol và thể tích khí hiđro (đktc) cần dùng.
Lời giải:a. Phân tử khối của HgO: M = 201 + 16 = 217(g/mol)
Số mol thủy ngân (II) oxit là: n = = = 0,1 (mol)
Phương trình phản ứng:
HgO + H2 → H2O + Hg
1 mol 1 mol 1mol 1 mol
0,1 0,1 0,1 0,1
Khối lượng thủy ngân thu được: m = 0,1.201 = 20,1 (g)
b. Số mol khí hiđro: n = 0,1 mol
Thể tích khí hiđro cần dùng ở đktc là:
V = 22,4.0,1 = 2,24 (lít)
Số mol khí hiđro là: nH2 = = 0,375 (mol)
Số mol khí oxi: nO2 = = 0,125 (mol)
Phương trình phản ứng:
2H2 + O2 2H2O
Ta thấy: tỉ lệ phản ứng của H2 và O2 là 2:1 O2 phản ứng hết, H2 dư
tính theo số mol của O2
Theo phương trình:
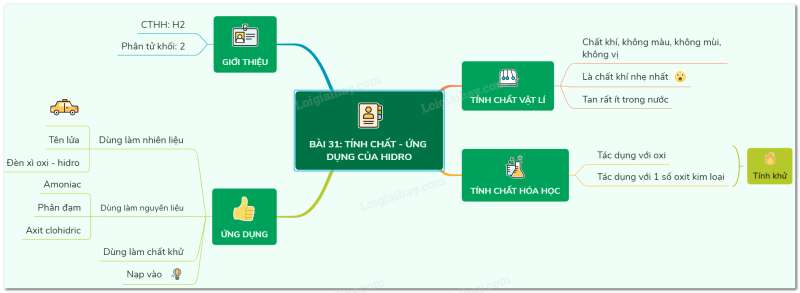
- Kí hiệu: H. Nguyên tử khối: 1
- Công thức hóa học của đơn chất: H2. Phân tử khối: 2
1. Tính chất vật lí
- Hiđro là chất khí, không màu, không mùi, không vị, nhẹ hơn không khí 14,5 lần.
- Tan rất ít trong nước.
- Hiđro là khí nhẹ nhất.
2. Tính chất hóa học
a. Tác dụng với oxi
Nếu đốt cháy hidro trong oxi: hidro cháy mạnh, trên thành lọ xuất hiện những giọt nước nhỏ
PTHH: 2H2 + O2 → 2H2O
Hỗn hợp sẽ gây nổ nếu trộn hidro và oxi theo tỉ lệ thể tích 2:1
b. Tác dụng với một số oxit kim loại
- Hiđro có tính khử, khử một số oxit kim loại ở nhiệt độ cao
H2 + CuO Cu + H2O
màu đen màu đỏ
3H2 + Fe2O3 2Fe + 3H2O
- H2 không tác dụng với các oxit: Na2O, K2O, BaO, CaO, MgO, Al2O3
3. Ứng dụng
Do tính chất nhẹ, tính khử và khi cháy tỏa nhiềt nhiệt mà hidro ứng dụng trong đời sống
- Làm nguyên liệu cho động cơ tên lửa, nhiên liệu cho động cơ ô tô thay cho xăng
- Làm nguyên liệu điều chế axit
- Dùng để điều chế kim loại từ oxit của chúng
- Bơm vào khinh khí cầu, bóng thám
Sơ đồ tư duy: Tính chất - ứng dụng của hiđro