Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Bài tập chuyên đề thi nghiệm Hóa Học lớp 12, tài liệu bao gồm 46 trang giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho kỳ thi môn Hóa học sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
BÀI TẬP HÌNH VẼ THÍ NGHIỆM
A. LƯU Ý CHUNG
I. Về dụng cụ và hóa chất
Trong bất kì hình vẽ nào ở SGK (đặc biệt năm 2017 là SGK lớp 12) cần chú ý một số điểm sau:
- Hóa chất sử dụng là những chất gì? Hóa chất có tác dụng gì?
- Dụng cụ lắp đặt: Nằm nghiêng hay ngang? Vai trò của nó trong bộ thí nghiệm? Phản ứng xảy ra trong dụng cụ chứa hóa chất là gì?
- Điều kiện phản ứng: Đặc, loãng, rắn, có cần đun nóng hay không?
- Thu khí bằng cách nào...
II. Điều chế một số chất khí trong phòng thí nghiệm
Chất lỏng + Chất rắn
Chất lỏng + Chất lỏng
Lưu ý: Khi điều chế khí etilen
Khí etilen sinh ra có lẫn CO2 và SO2. Để khí không lẫn tạp chất thì cần phải dẫn qua bông tẩm NaOH đặc để loại bỏ 2 khí này.
Phản ứng xảy ra ở 170°C nên phải cho đá bọt vào để hỗn hợp không sôi đột ngột và quá mạnh sẽ trào chất lỏng ra ngoài, không đảm bảo an toàn khi làm thí nghiệm.
Chất rắn + Chất rắn (ống nghiệm chứa hóa chất nằm ngang, miệng hơi chúc xuống)
Đọc thêm:
+ Điều chế oxi
- Nếu điều chế oxi bằng nhiệt phân chất rắn thì lắp ống nghiệm sao cho miệng ống nghiệm hơi chúc xuống để đề phòng hỗn hợp có chất rắn ẩm, khi đun hơi nước không chảy ngược lại làm vỡ ống nghiệm.
- Khi ngừng thu khí, phải tháo rời ống dẫn khí rồi mới tắt đèn cồn tránh hiện tượng nước tràn vào ống nghiệm khi ngừng đun.
- KClO3 là chất dễ gây nổ nên không nghiền nhiều mọt lúc và không nghiền lẫn với bất kì chất nào khác. Lọ đựng KClO3 không để hở nút cạnh: P, C, S nút lọ đựng KClO3 không độn giấy vào
- Từ: KMnO4 điều chế oxi tuy ít hơn từ KClO3 nhưng dễ mua không cần dùng chất xúc tác và ít gây nguy hiểm
- Khi thu khí O2, đề kiểm tra O2 đã đầy bình chưa ta đưa tàn đóm đỏ vào miệng bình thấy bùng cháy chửng tò O2 đã đầy bình
+ Điều chế NH3
Điều chế khí amoniac trong phòng thí nghiệm
+ Làm khô khí bằng CaO. Để điều chế một lượng nhỏ NH3 thì đun nóng dung dịch NH3 đậm đặc
+ Điều chế CH4
- Thu metan bằng phương pháp đẩy nước do oxi không tan trong nước.
- Phải dùng CaO mới, không dùng CaO đã rã, CH3COONa phải thật khan trước khi làm thí nghiệm. Nếu hỗn hợp phản ứng bị ẩm thì phản ứng xảy ra chậm.
- Phải đun nóng bình cầu khí metan mới thoát ra không để ngọn lửa lại gần miệng ống thoát khí.
- Khi ngừng thu khí, phải tháo rời ống dẫn khí rồi mới tắt đèn cồn tránh hiện tượng nước tràn vào ống nghiệm khi ngừng đun.
- Khi tháo rời thiết bị nên làm trong tủ hút và tắt hết lửa xung quanh
- Sử dụng glixerol để bôi trơn bề mặt tiếp xúc giữa thủy tinh và cao su
III. Cách thu khí.
Phải nắm vững tính chất vật lý ( tính tan và tỉ khối) để áp dụng phương pháp thu khí đúng.
- Thu theo phƣơng pháp đẩy không khí:
+ Khí không phản ứng với oxi của không khí.
+ Nặng hơn hoặc nhẹ hơn không khí (CO2, SO2, Cl2, H2, NH3...). Úp ống thu? Ngửa ống thu?
- Thu theo phƣơng pháp đẩy nƣớc:
+ Khí ít tan trong nước. (H2, O2, CO2, N2, CH4, C2H4, C2H2...).
- Các khí tan nhiều trong nước (khí HCl, khí NH3):
+ Ở 20oC, 1 thể tích nước hòa tan tới gần 500 thể tich khi hiđro clorua.
+ Ở điều kiện thường, 1 lít nước hòa tan khoảng 800 lít khí amoniac.
Lưu ý: SO2 là khí tan nhiều trong nước chứ không giống như CO2 đâu.
IV. Làm khô khí
Nguyên tắc chọn chất làm khô
Giữ được nước và không có phản ứng với chất cần làm khô.Copyright © 2017 Nguyễn Công Kiệt
- Các chất làm khô: H2SO4 đặc, P2O5, CaO (vôi sống, mới nung), CuSO4 (khan, màu trắng), CaCl2(khan), NaOH, KOH (rắn hoặc dung dịch đậm đặc).
- Các khí: H2, Cl2, HCl, HBr, HI, O2, SO2, H2S, N2, NH3, CO2 , C2H4, C2H2...
Ví dụ: H2SO4 đặc (tính axit, tính oxi hóa):
+ Không làm khô được khí NH3 (tính bazơ),
+ Không làm khô được khí HBr, HI (tính khử).
+ H2SO4 đặc làm khô được khí Cl2, O2, SO2, N2, CO2...
CaO (vôi sống), NaOH, KOH (rắn) (tính bazơ):
+ Không làm khô được khí CO2, SO2 (oxit axit), Cl2 (có phản ứng).
+ Làm khô được khí NH3, H2, O2, N2...
V. Tách và tinh chế các chất
a) Nguyên tắc chung:
• Các chất ở trạng thái khác nhau (lỏng - rắn, lỏng - khí, rắn - khí) thì tách được ra khỏi nhau.
• Các chất lòng không tan vào nhau thì tách được ra khỏi nhau.
• Các chất rắn có kích thước khác nhau thì tách được ra khỏi nhau.
• Các chất có khối lượng riêng khác nhau thì tách được ra khỏi nhau.
Ngoài ra còn dựa vào sự khác nhau về tính chất vật lí (có từ tính, thăng hoa, khả năng hấp thụ. hấp
phụ,...). tính chất hóa học để tách chất
b) Các phương pháp điển hình
• Phương pháp chưng cất
- Cơ sở của phương pháp chưng cất: Dựa vào nhiệt độ sôi khác nhau của các chất lỏng trong hỗn hợp.
- Nội dung phương pháp chưng cất: Khi đun sôi một hỗn hợp lỏng, chất nào có nhiệt độ sôi thấp hơn sẽ chuyển thành hơi sớm hơn và nhiều hơn. Khi gặp lạnh, hơi sẽ ngưng tụ thành dạng lỏng chứa chủ yếu là chất có nhiệt độ sôi thấp hơn.
• Phương pháp chiết
- Cơ sở của phương pháp chiết: Dựa vào độ tan khác nhau trong nước hoặc trong dung môi khác của các chất lỏng, chất rắn.Khi hai chất lỏng không trộn lẫn được vào nhau chất lỏng nào có khối lượng riêng nhỏ hơn sẽ tách thành lớp trên, chất lỏng nào có khối lượng riêng lớn hơn sẽ nằm ở phía dưới.
- Nội dung của phương pháp chiết: Dùng dụng cụ chiết (phễu chiết) tách các chất lòng không hòa tan vào nhau ra khỏi nhau (chiết lỏng - lỏng). Người ta còn thường dùng chất lỏng hoà tan chất hữu cơ để tách chúng ra khỏi hồn hợp rắn (chiết lỏng - rắn).
• Phương pháp kết tinh
- Cơ sở của phương pháp kết tinh: Dựa vào độ tan khác nhau của các chất rắn theo nhiệt độ.
- Nội dung của phương pháp kết tinh: Hòa tan chất rắn vào dung môi đến bão hòa, lọc tạp chất rồi cô cạn, chất rắn trong dung dịch sẽ kết tinh ra kliòi dung dịch theo nhiệt độ (chất tách ra có thể ngậm
nước)
• Phương pháp lọc
Cơ sờ của phương pháp lọc: Dùng để tách các chất không tan ra khỏi hỗn hợp lỏng
Thí dụ: Đường bị lẫn một ít cát. Để làm sạch đường bằng phương pháp vật lí ta hòa tan hỗn hợp đường và cát vào nước. Khi đó đường bị tan vào nước còn lại cát không tan. Cho giấy lọc vào phễu, lọc và thu phần nước lọc, đem cô cạn phần nước lọc ta thu được đường.
• Phương pháp từ tính
Cơ sở của phương pháp từ tính: Dùng để tách chất bị nhiễm từ (bị nam châm hút) ra khỏi hỗn hợp rắn gồm chát bị nhiễm từ và chất không bị nhiễm từ (Một số chất bị nhiễm từ là Fe. Fe3O4,...).
Thí dụ: Để tách riêng Fe và Cu ra khỏi hỗn hợp bằng phương pháp vật lí ta dùng thanh nam châm (đã bọc nilon mỏng), chà nhiều lần lên hỗn hợp. Do sắt có tính nhiễm từ nên bị hút vào thanh nam châm, còn đồng thì không bị hút do không có tính nhiễm từ. Làm đi làm lại nhiều lần ta thu được sắt riêng, đồng riêng.
• Phương pháp lắng gạn
Cơ sở của phương pháp lắng gạn: Dùng để tách các chất rắn có khối lượng liêng khác nhau ra khỏi nước hoặc đung dịch.
Thỉ dụ: Bột CuO bị lẫn bột than. Để tách riêng bột CuO ra khỏi hồn hợp bằng phương phápvật lí ta cho hỗn hợp trên vào cốc, thêm nước vào, khấy đều rồi lắng gạn. Làm đi làm lại nhiều lần, bột than nhẹ sẽ trôi theo nước ra ngoài, bột CuO chìm xuống đáy. Lúc này ta thu được CuO bằng phương pháp lọc.
Ghi chú: Ngoài các phương pháp trên còn nhiều phương pháp khác như: phương pháp điện di, thẩm thấu, săc ký, li tâm, hấp phụ, thăng hoa,...
B. BÀI TẬP VẬN DỤNG
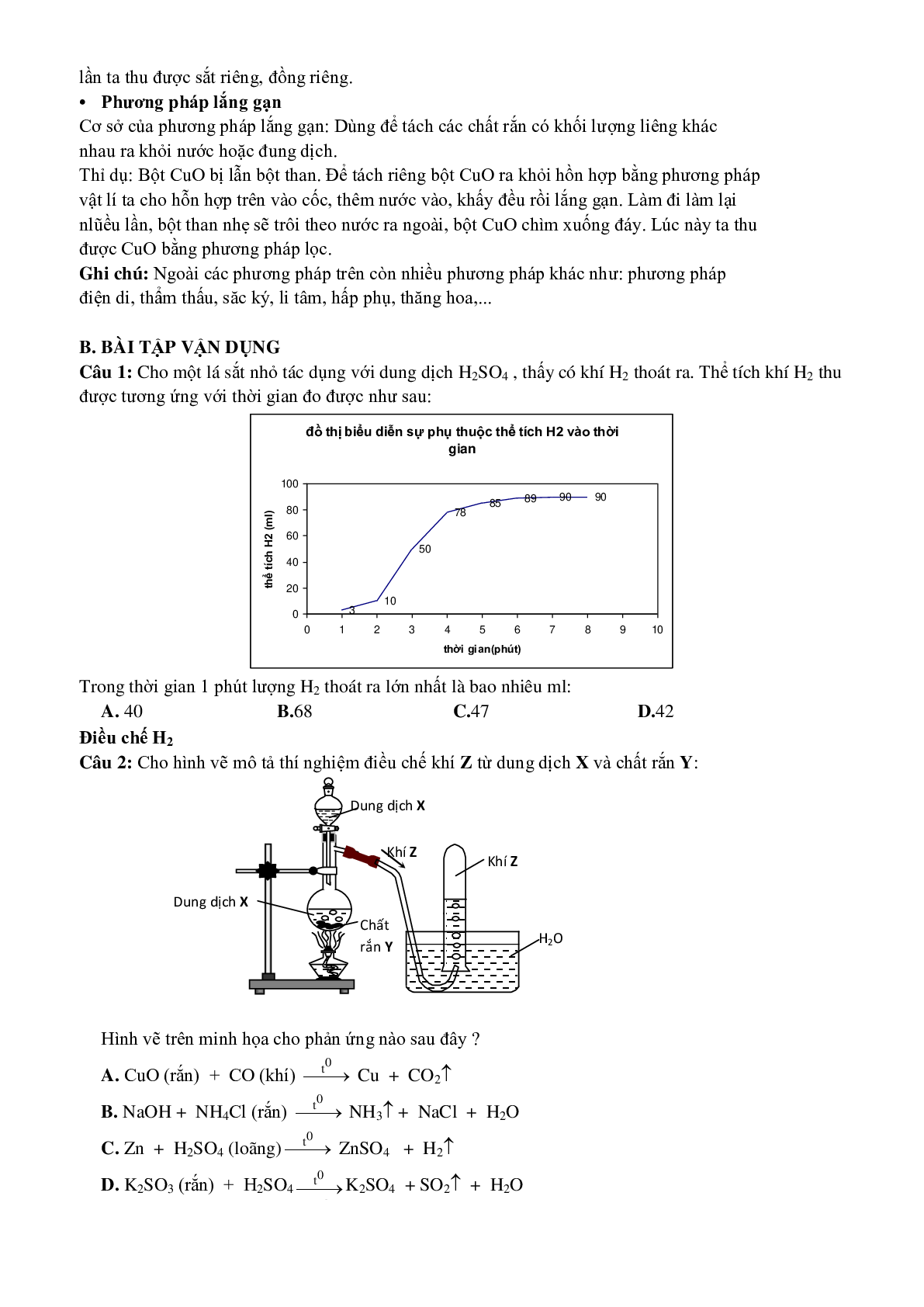
Câu 1: Cho một lá sắt nhỏ tác dụng với dung dịch H2SO4 , thấy có khí H2 thoát ra. Thể tích khí H2 thu được tương ứng với thời gian đo được như sau:
Trong thời gian 1 phút lượng H2 thoát ra lớn nhất là bao nhiêu ml:
A. 40 B.68 C.47 D.42
Điều chế H2
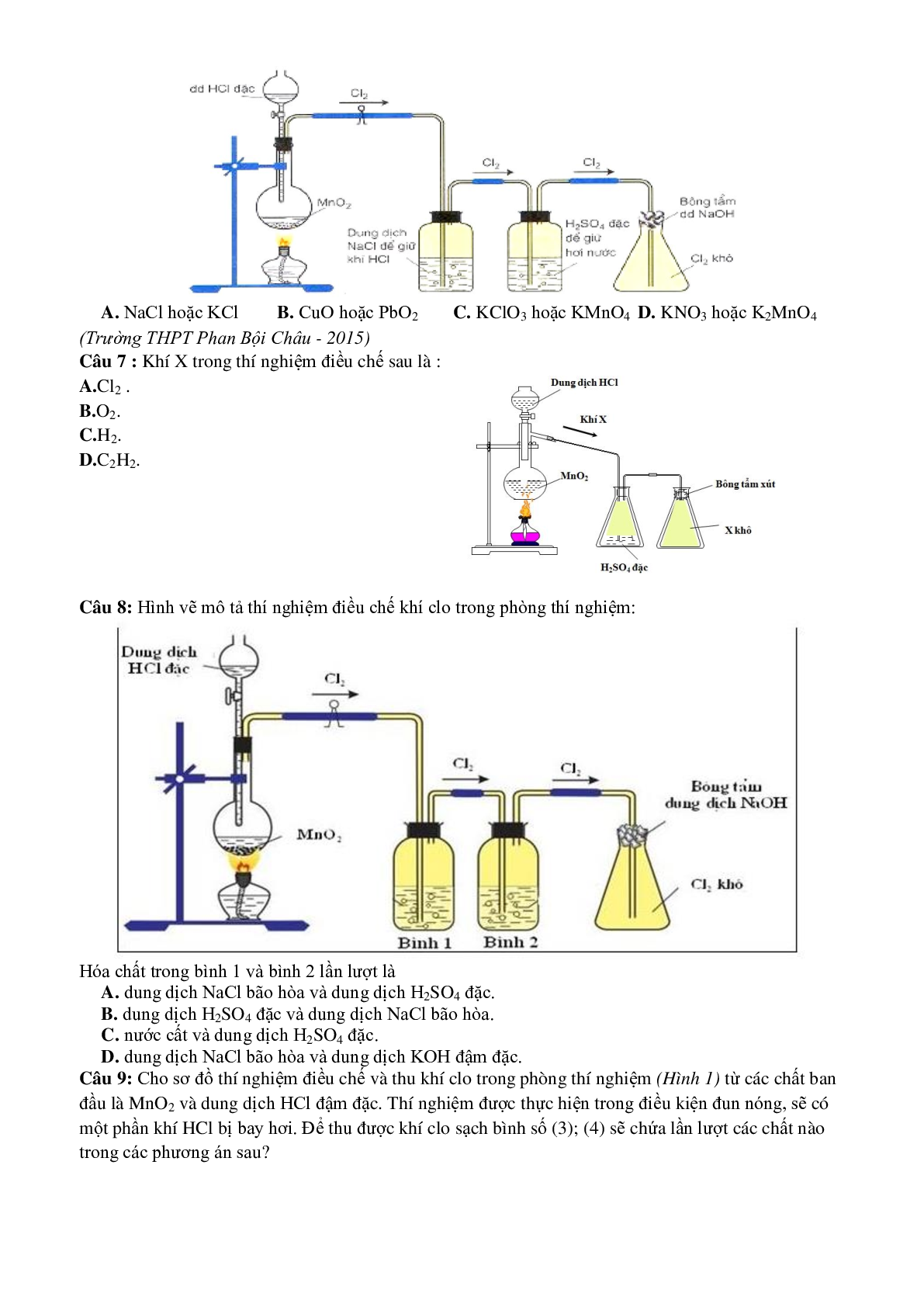
Câu 3: Cho hình thí nghiệm sau: chất B và chất X tương ứng lần lượt là:
A. KClO3 và O2
B. MnO2 và Cl2
C. Zn và H2
D. C2H5OH và C2H4
(Trường THPT Chuyên Trần Phú - 2015)
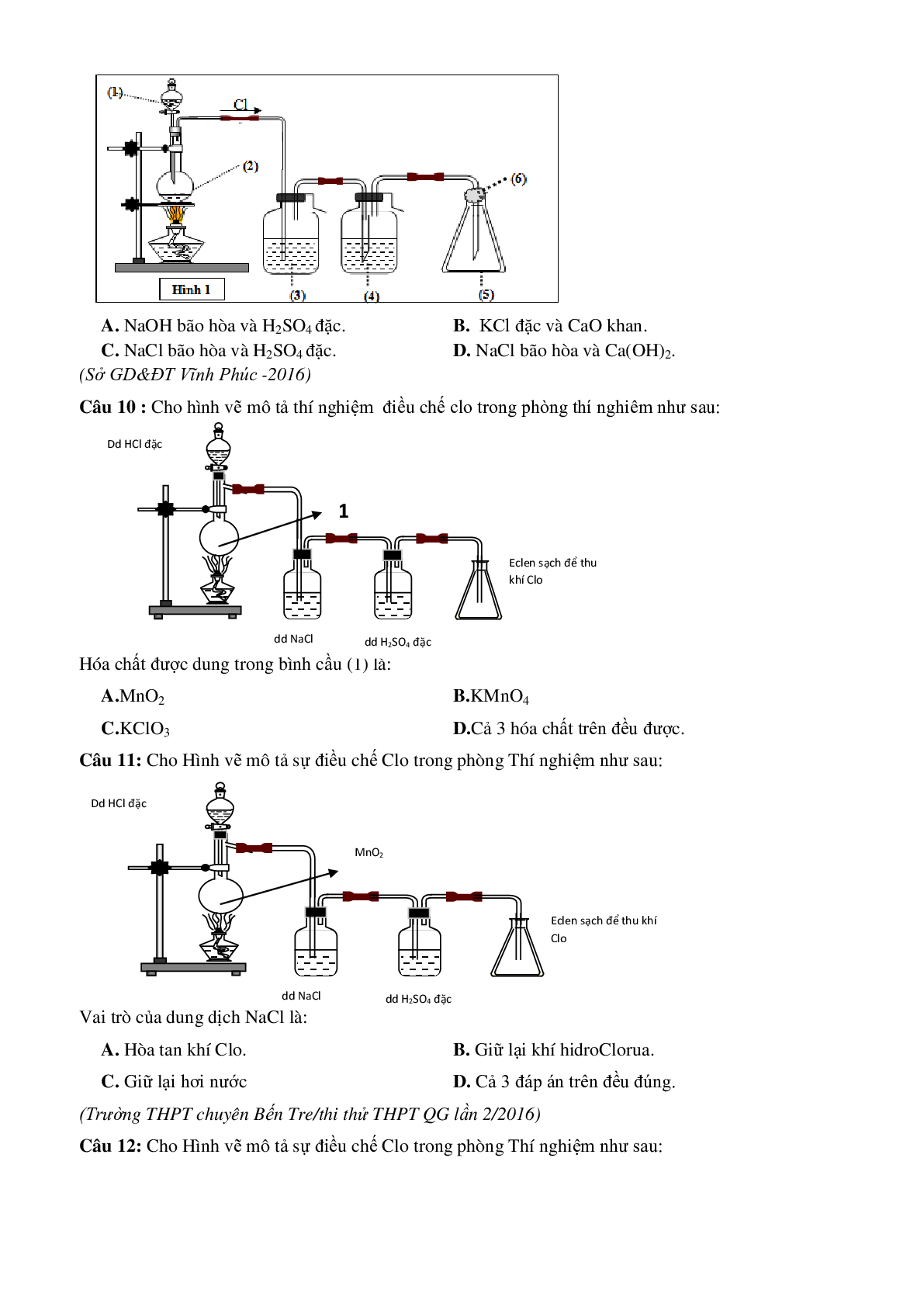
Điều chế Clo trong phòng thí nghiêm
Câu 4: Cho biết bộ thí nghiệm điều chế Clo trong phòng thí nghiệm:
Hãy cho biết hóa chất đựng trong mỗi bình tương ứng lần lượt là:
A. dd HCl, MnO2 rắn, dd NaCl, dd H2SO4 đặc
B. dd NaCl, MnO2 rắn, dd HCl, dd H2SO4 đặc
C. dd HCl, dung dịch KMnO4, dd H2SO4 đặc, dd Nacl
D. D. dd H2SO4 đặc, dd KMnO4, dd HCl, dd NaCl
Câu 5: Cho hình vẽ mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl:
Khí Cl2 sinh ra thường lẫn hơi nước và hiđro clorua. Để thu được khí Cl2 khô thì bình (1) và bình (2) lần lượt đựng
A. dung dịch NaOH và dung dịch H2SO4 đặc.
B. dung dịch H2SO4 đặc và dung dịch NaCl.
C. dung dịch H2SO4 đặc và dung dịch AgNO3.
D. dung dịch NaCl và dung dịch H-2SO4 đặc.
Câu 7 : Khí X trong thí nghiệm điều chế sau là :
A.Cl2 .
B.O2.
C.H2.
D.C2H2.
Câu 8: Hình vẽ mô tả thí nghiệm điều chế khí clo trong phòng thí nghiệm:
Hóa chất trong bình 1 và bình 2 lần lượt là
A. dung dịch NaCl bão hòa và dung dịch H2SO4 đặc.
B. dung dịch H2SO4 đặc và dung dịch NaCl bão hòa.
C. nước cất và dung dịch H2SO4 đặc.
D. dung dịch NaCl bão hòa và dung dịch KOH đậm đặc.
Câu 9: Cho sơ đồ thí nghiệm điều chế và thu khí clo trong phòng thí nghiệm (Hình 1) từ các chất ban đầu là MnO2 và dung dịch HCl đậm đặc. Thí nghiệm được thực hiện trong điều kiện đun nóng, sẽ có một phần khí HCl bị bay hơi. Để thu được khí clo sạch bình số (3); (4) sẽ chứa lần lượt các chất nào trong các phương án sau:
A. NaOH bão hòa và H2SO4 đặc. B. KCl đặc và CaO khan.
C. NaCl bão hòa và H2SO4 đặc. D. NaCl bão hòa và Ca(OH)2.
Câu 10 : Cho hình vẽ mô tả thí nghiệm điều chế clo trong phòng thí nghiêm như sau:
Hóa chất được dung trong bình cầu (1) là:
A.MnO2 B.KMnO4
C.KClO3 D.Cả 3 hóa chất trên đều được
Câu 11: Cho Hình vẽ mô tả sự điều chế Clo trong phòng Thí nghiệm như sau:
Vai trò của dung dịch NaCl là:
A. Hòa tan khí Clo. B. Giữ lại khí hidroClorua.
C. Giữ lại hơi nước D. Cả 3 đáp án trên đều đúng
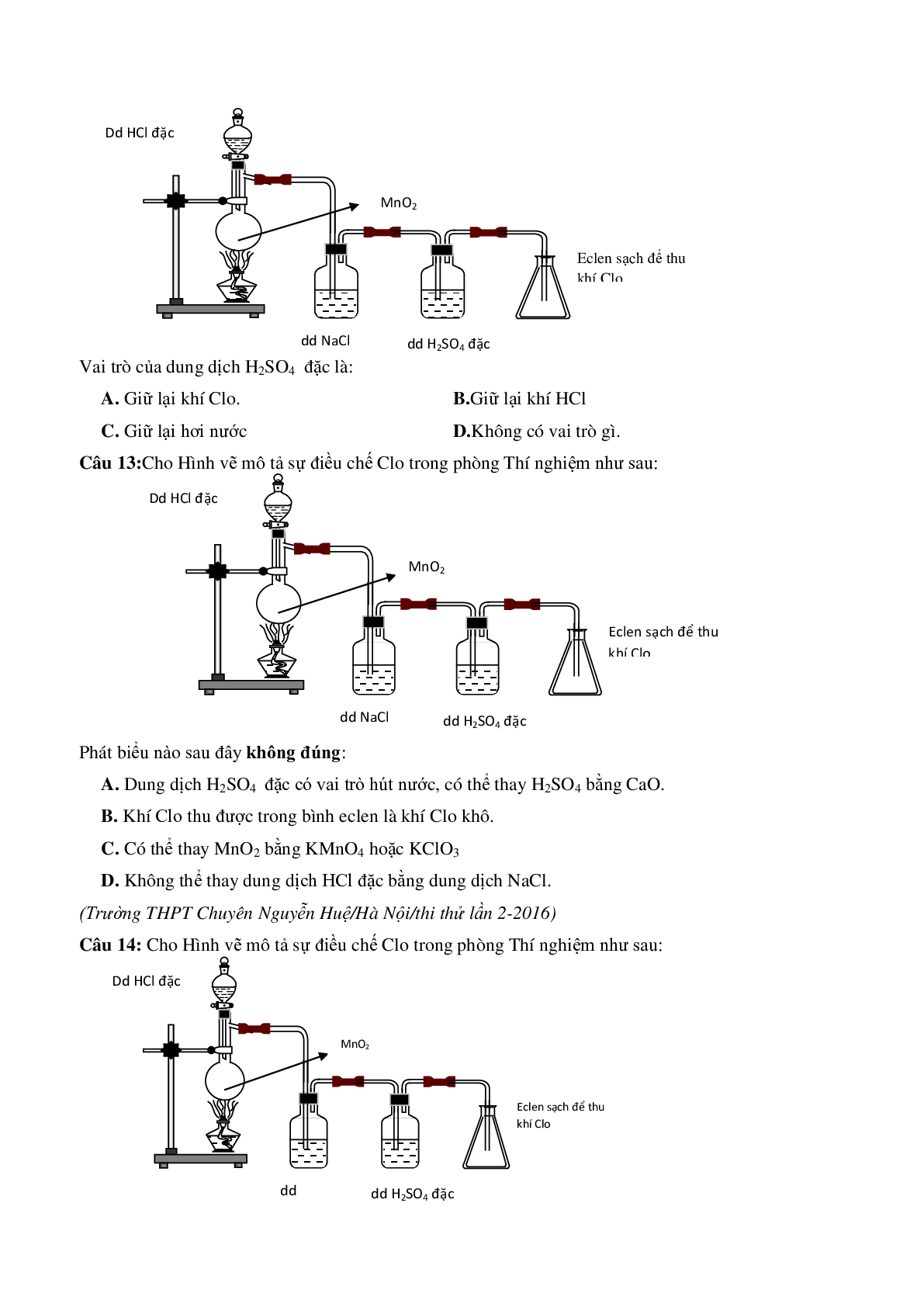
Câu 12: Cho Hình vẽ mô tả sự điều chế Clo trong phòng Thí nghiệm như sau:
Vai trò của dung dịch H2SO4 đặc là:
A. Giữ lại khí Clo. B.Giữ lại khí HCl
C. Giữ lại hơi nước D.Không có vai trò gì
Câu 13:Cho Hình vẽ mô tả sự điều chế Clo trong phòng Thí nghiệm như sau:
Phát biểu nào sau đây không đúng:
A. Dung dịch H2SO4 đặc có vai trò hút nước, có thể thay H2SO4 bằng CaO.
B. Khí Clo thu được trong bình eclen là khí Clo khô.
C. Có thể thay MnO2 bằng KMnO4 hoặc KClO3
D. Không thể thay dung dịch HCl đặc bằng dung dịch NaCl.
Câu 14: Cho Hình vẽ mô tả sự điều chế Clo trong phòng Thí nghiệm như sau:
Khí Clo thu được trong bình eclen là:
A. Khí clo khô B. Khí clo có lẫn H2O
C. Khí clo có lẫn khí HCl D. Cả B và C đều đúng.
Câu 15: Trong sơ đồ thí nghiệm điều chế khí clo trong phòng thí nghiệm, vai trò của từng dụng cụ nào sau đây không chính xác?
A. MnO2 đựng trong bình cầu có thể thay thế bằng KMnO4, K2Cr2O7, CaCl2
B. Dung dịch NaCl để giữ khí HCl
C. H2SO4 đặc để giữ hơi nước
D. Bình đựng khí clo phải có nút bông tẩm dung dịch kiềm
Câu 16: Cho Hình vẽ mô tả sự điều chế clo trong phòng Thí nghiệm như sau:
Phát biểu nào sau đây không đúng:
A. Không thể thay dung dịch HCl đặc bằng dung dịch NaCl bão hoà.
B. Khí clo thu được trong bình tam giác là khí clo khô.
C. Có thể thay MnO2 bằng KMnO4 hoặc KClO3.
D. Có thể thay H2SO4 đặc bằng CaO và thay dung dịch NaCl bằng dung dịch NaOH
Câu 17: Hình bên mô tả thí nghiệm điều chế Cl2 trong phòng thí nghiệm, dung dịch X và Y lần lượt là:
A. NaCl và NaOH B. NaCl và Na2CO3 C. NaOH và Na2CO3. D. NaOH và NaCl
Câu 18: Hiện tượng xảy ra trong thí nghiệm bên là:
A. Có khí màu vàng sinh ra, đồng thời có kết tủa
B. Chỉ có khí màu vàng thoát ra
C. Chất rắn MnO2 tan dần
D. Cả B và C
Câu 19: Trong thí nghiệm ở hình bên người ta dẫn khí clo mới điều chế từ MnO2 rắn và dung dịch axit HCl đặc. Trong
ống hình trụ có đặt một miếng giấy màu. Hiện tượng gì xảy ra với giấy màu khi lần lượt : a) Đóng khóa K; b) Mở khóa K
A. a) Mất màu; b) Không mất màu
B. a) Không mất màu; b) Mất màu
C. a) Mất màu; b) Mất màu
D. a) Không mất màu; b) Không mất màu
THÍ NGHIỆM VỀ KHÍ HIDRO CLORUA
Câu 20: Tiến hành thí nghiệm như hình vẽ. Khí A trong bình có thể là khí nào dưới đây?
A. NH3 B. SO2
C. HCl D. H2S
Câu 21: Cho TN về tính tan của khi HCl như hình vẽ,Trong bình ban đầu chứa khí HCl, trong nước có nhỏ thêm vài giọt quỳ tím.Hiện tượng xảy ra trong bình khi cắm ống thủy tinh vào nước:
A. Nước phun vào bình và chuyển sang màu đỏ
B. Nước phun vào bình và chuyển sang màu xanh
C. Nước phun vào bình và vẫn có màu tím
D. Nước phun vào bình và chuyển thành không màu.
Câu 22: Khí hidro clorua là chất khí tan rất nhiều trong nước tạo thành dung dịch axit clohdric.
Trong thí nghiệm thử tính tan của khí hidroclorua trong nước, có hiện tượng nước phun mạnh vào bình chứa khí như hình vẽ mô tả dưới đây. Nguyên nhân gây nên hiện tượng đó là:
A. Do khí HCl tác dụng với nước kéo nước vào bình.
B. Do HCl tan mạnh làm giảm áp suất trong bình.
C. Do trong bình chứa khí HCl ban đầu không có nước.
D. Tất cả các nguyên nhân trên đều đúng
ĐIỀU CHẾ HCl
Câu 23: Cho hình vẽ mô tả quá trình điều chế dung dịch HCl trong phòng thí nghiệm
Phát biểu nào sau đây là không đúng:
A. NaCl dùng ở trạng thái rắn
B. H2SO4 phải đặc
C. Phản ứng xảy ra ở nhiệt độ phòng.
D. Khí HCl thoát ra hòa tan vào nước cất tạo thành
dung dịch axit Clohidric
Câu 24: Cho hình vẽ mô tả quá trình điều chế dung dịch HCl trong phòng thí nghiệm:
Phải dùng NaCl rắn, H2SO4 đặc và phải đun nóng vì:
A. Khí HCl tạo ra có khả năng tan trong nước rất mạnh.
B. Đun nóng để khí HCl thoát ra khỏi dung dịch
C. Để phản ứng xảy ra dễ dàng hơn
D. Cả 3 đáp án trên