Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Bài tập về ứng dụng phương pháp đồ thị trong giải toán hóa học môn Hóa học lớp 12, tài liệu bao gồm 18 trang, đầy đủ lý thuyết, phương pháp giải chi tiết và bài tập có đáp án (có lời giải), giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi tốt nghiệp THPT môn Hóa học sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
I VỌNG NÓ SẼ GIÚP PHẦN NÀO YÊN TÂM HƠN TRƯỚC KHI BƯỚC VÀO KỲ THI CĐ-
ĐH NĂM 2011.
( gồm CKV1,2,3,4,5,9,11,12,13, 20).
ỨNG DỤNG PHƯƠNG PHÁP ĐỒ THỊ TRONG GIẢI TOÁN HOÁ HỌC
I. CƠ SỞ LÝ THUYẾT
Chúng ta thường gặp các dạng bài toán khi cho oxit axit CO2, SO2 tác dụng với dung dịch NaOH,
KOH, Ca(OH)2 hay Ba(OH)2 thu được muối, kết tủa, …đó cũng là những dạng bài toán khó và có nhiều
trường hợp xãy ra trong bài toán.
1. Dạng bài toán “cho oxit axit CO2, SO2 tác dụng với dung dịch Ca(OH)2, Ba(OH)2 thu được kết
tủa”.
a. Điều kiện bài toán:
Tính
nCO2 biết nCa(OH)2 và nCaCO3 hoặc ngược lại, cho biết số mol nCO2 , nCa(OH)2
Tính
nCaCO3 ta có các phản ứng xãy ra như sau:
CO2 + Ca(OH)2 CaCO3 + H2O (1)
CaCO3 + CO2 + H2O Ca(HCO3)2 (2)
2CO2 + Ca(OH)2 Ca(HCO3)2 (3)
b. Phương pháp vẽ đồ thị:
Từ trục hoành(Ox) chọn hai điểm a và 2a, từ trục tung (Oy) chọn một điểm a. Tại điểm a của trục
x và y kẻ vuông góc và chúng giao nhau tại điểm A. Từ A nối với toạ độ O và 2a ta được tam giác vuông
cân. Với số mol kết tủa từ trục y cắt tam giác ở một hoặc hai điểm. Tại đó kẻ vuông góc với trục x ta
được số mol CO2 tham gia phản ứng có thể xãy ra 2 trường hợp:
+ Trường hợp 1:
nCO2 = n1 mol.= y mol
+ Trường hợp 2:
nCO2 = n2 mol= 2a-y mol
2
3
2
Ca(OH)
CaCO
CO
n a mol
n y mol
n ymol
2a ymol
2
1
CO 2
= n
n = n
Nếu chúng ta gặp một bài toán khi cho oxit axit CO2 tác dụng với dung dịch Ca(OH)2 hay Ba(OH)2 thu
được x mol kết tủa và sau đó đun nóng thu được y mol kết tủa nữa thì áp dụng công thức tính nhanh sau,
nCO2 x 2y
3. bài toán áp dụng
CaCO
3
CO
2
a
n
1 a n2 2a
http://aotrangtb.com
See on Aotrangtb.com2
Bài toán 1: ( Trích câu 5 trang 119. bài 26: kim loại kiềm thổ và hợp chất của kim loại kiềm thổ. SGK
ban cơ bản).
Cho 2,8 gam CaO tác dụng với một lượng nước dư thu được đung dịch A. Sục 1,68 lít khí CO2
(đktc) vào dung dịch A:
a. Tính khối lượng kết tủa thu được.
b. Khi đun nóng dung dịch A thì khối lượng kết tủa thu được là bao nhiêu?
BÀI GIẢI
2
2
CaO 2 2
CO
Ca
n 2,8 0,05mol,CaO H O Ca(OH)
56
n 0,05mol,n 1,68 0,075mol
22,4
Khi sục khí CO2 vào dung dịch nước vôi trong Ca(OH)2 ta có các phương trình phản ứng
xãy ra:
CO2 + Ca(OH)2 CaCO3 + H2O (1)
2CO2 + Ca(OH)2 Ca(HCO3)2 (2)
Khi đun nóng dung dịch ta có phương trình phản ứng xãy ra:
Ca(HCO3)2 CaCO3 + CO2 + H2O (3)
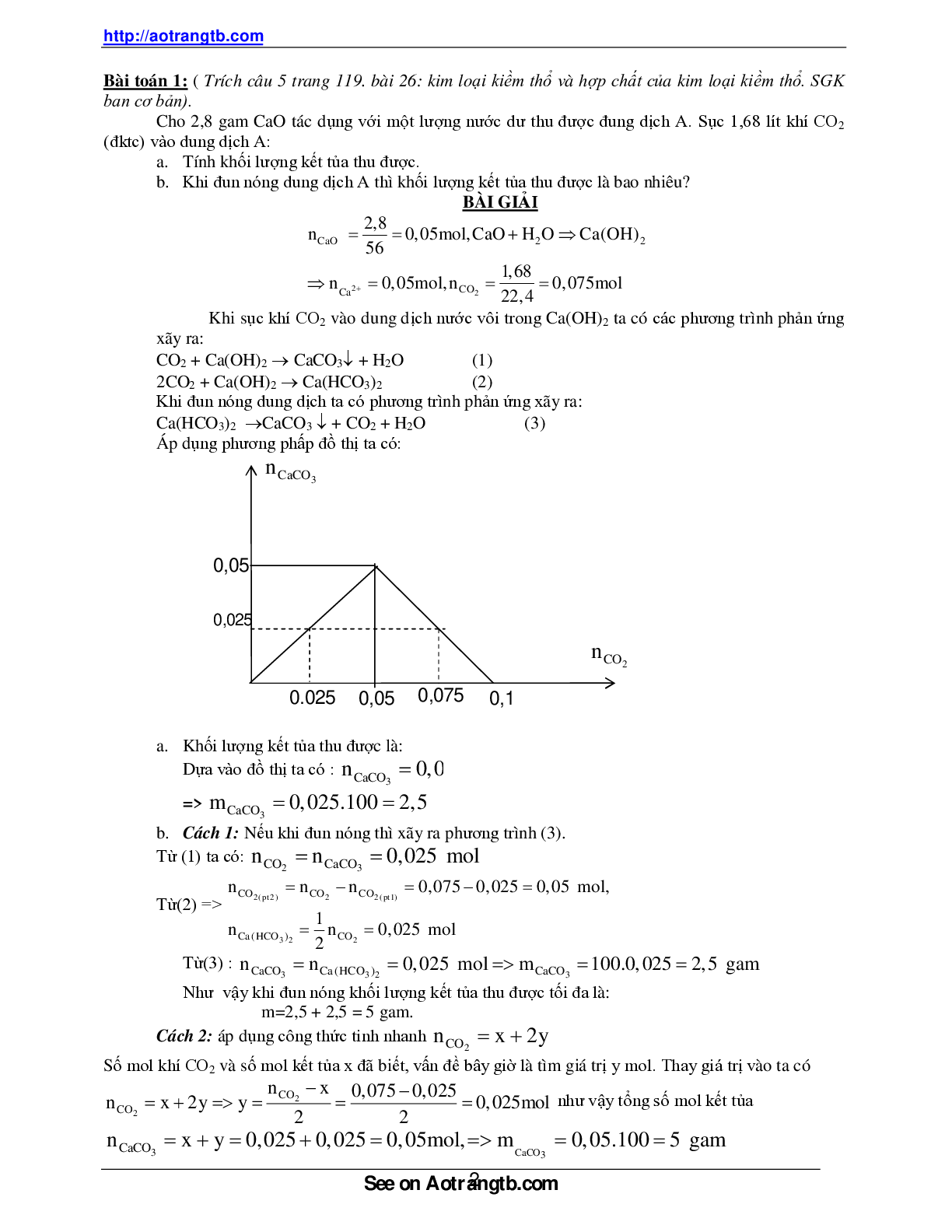
Áp dụng phương phấp đồ thị ta có:
a. Khối lượng kết tủa thu được là:
Dựa vào đồ thị ta có :
nCaCO3 0,025 mol
=>
mCaCO3 0,025.100 2,5 gam
b. Cách 1: Nếu khi đun nóng thì xãy ra phương trình (3).
Từ (1) ta có:
nCO2 nCaCO3 0,025 mol
Từ(2) => 2( pt 2) 2 2( pt1)
3 2 2
CO CO CO
Ca(HCO ) CO
n n n 0,075 0,025 0,05 mol,
1
n n 0,025 mol
2
Từ(3) :
nCaCO3 nCa(HCO )3 2 0,025 mol mCaCO3 100.0,025 2,5 gam
Như vậy khi đun nóng khối lượng kết tủa thu được tối đa là:
m=2,5 + 2,5 = 5 gam.
Cách 2: áp dụng công thức tinh nhanh
nCO2 x 2y
Số mol khí CO2 và số mol kết tủa x đã biết, vấn đề bây giờ là tìm giá trị y mol. Thay giá trị vào ta có
2
2
CO
CO
n x 0,075 0,025
n x 2y y 0,025mol
2 2
như vậy tổng số mol kết tủa
3 CaCO
nCaCO x y 0,025 0,025 0,05mol, m 3 0,05.100 5 gam
nCaCO3
nCO2
0,05
0,025
0.025 0,05 0,075 0,1
http://aotrangtb.com
See on Aotrangtb.com3
Bài toán 2: ( Trích câu 2 trang 132. bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và
hợp chất của chúng. SGK ban cơ bản).
Sục 6,72 lít khí CO2 (đktc) vào dung dịch có chứa 0,25 mol Ca(OH)2 . Khối lượng gam kết tủa
thu được là:
A. 10 gam B. 15 gam. C. 20 gam. D. 25 gam.
BÀI GIẢI:
+ Cách 1: giải thông thường:
2 2
2
OH
CO Ca(OH)
CO
6,72 n 0,5
n 0,3mol ,n 0,25mol,1 2
22,4 n 0,3
xãy ra 2 phương trình:
CO2 + Ca(OH)2 CaCO3 + H2O (1)
2CO2 + Ca(OH)2 Ca(HCO3)2 (2)
Gọi x, y lần lượt là số mol CO2 của phương trình (1) và (2). Ta có hệ phương trình:
x y 0,3
x y 0,25
2
Giải hệ phương trình ta được: x=0,2 mol, y= 0,1 mol.
mCaCO3 0,2.100 20 gam , đáp án đúng là C.
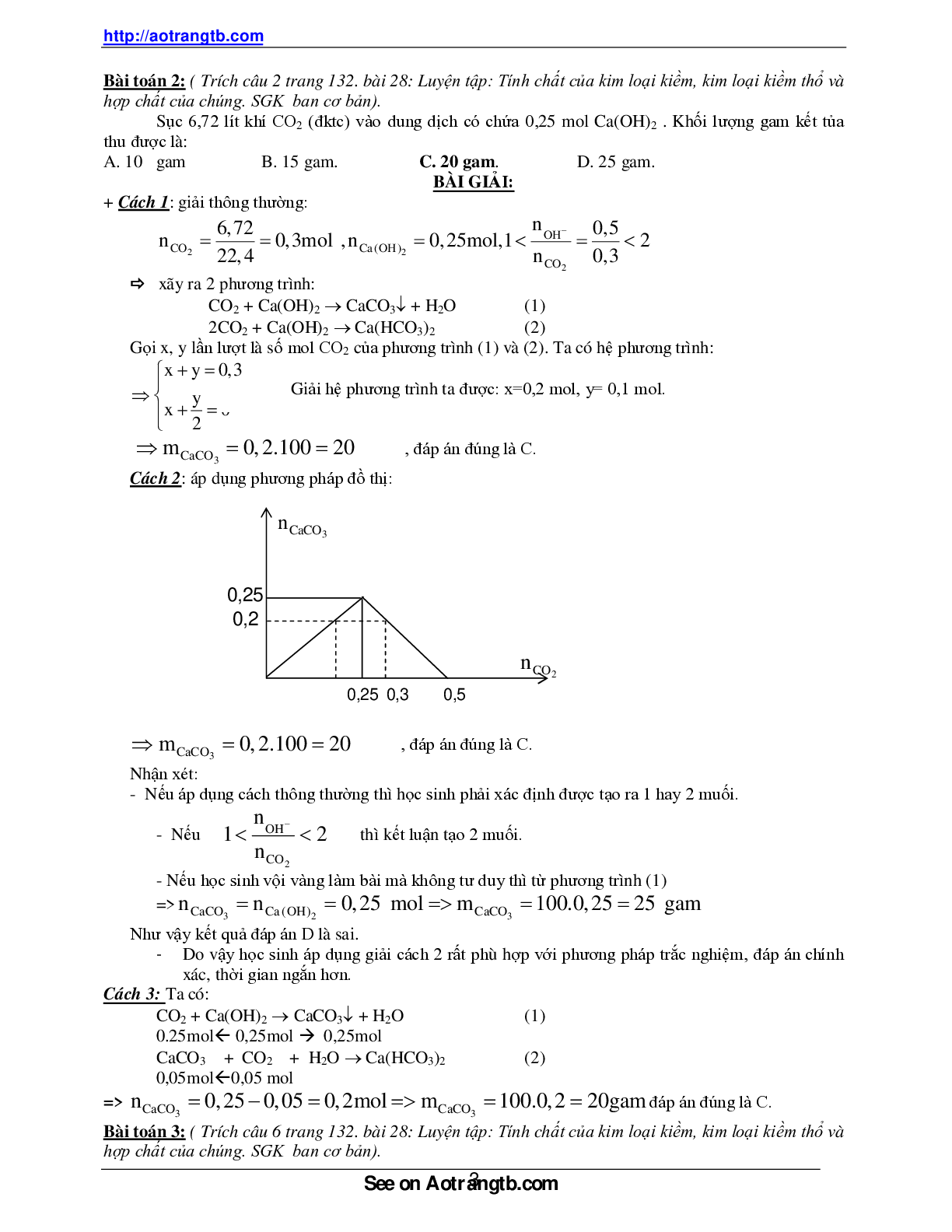
Cách 2: áp dụng phương pháp đồ thị:
mCaCO3 0,2.100 20 gam , đáp án đúng là C.
Nhận xét:
- Nếu áp dụng cách thông thường thì học sinh phải xác định được tạo ra 1 hay 2 muối.
- Nếu
2
OH
CO
n
1 2
n
thì kết luận tạo 2 muối.
- Nếu học sinh vội vàng làm bài mà không tư duy thì từ phương trình (1)
=>
nCaCO3 nCa (OH)2 0,25 mol mCaCO3 100.0,25 25 gam
Như vậy kết quả đáp án D là sai.
- Do vậy học sinh áp dụng giải cách 2 rất phù hợp với phương pháp trắc nghiệm, đáp án chính
xác, thời gian ngắn hơn.
Cách 3: Ta có:
CO2 + Ca(OH)2 CaCO3 + H2O (1)
0.25mol 0,25mol 0,25mol
CaCO3 + CO2 + H2O Ca(HCO3)2 (2)
0,05mol0,05 mol
=>
nCaCO3 0,25 0,05 0,2mol mCaCO3 100.0,2 20gam đáp án đúng là C.
Bài toán 3: ( Trích câu 6 trang 132. bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và
hợp chất của chúng. SGK ban cơ bản).
nCO2
0,25
0,25 0,3 0,5
nCaCO3
0,2
http://aotrangtb.com
See on Aotrangtb.com4
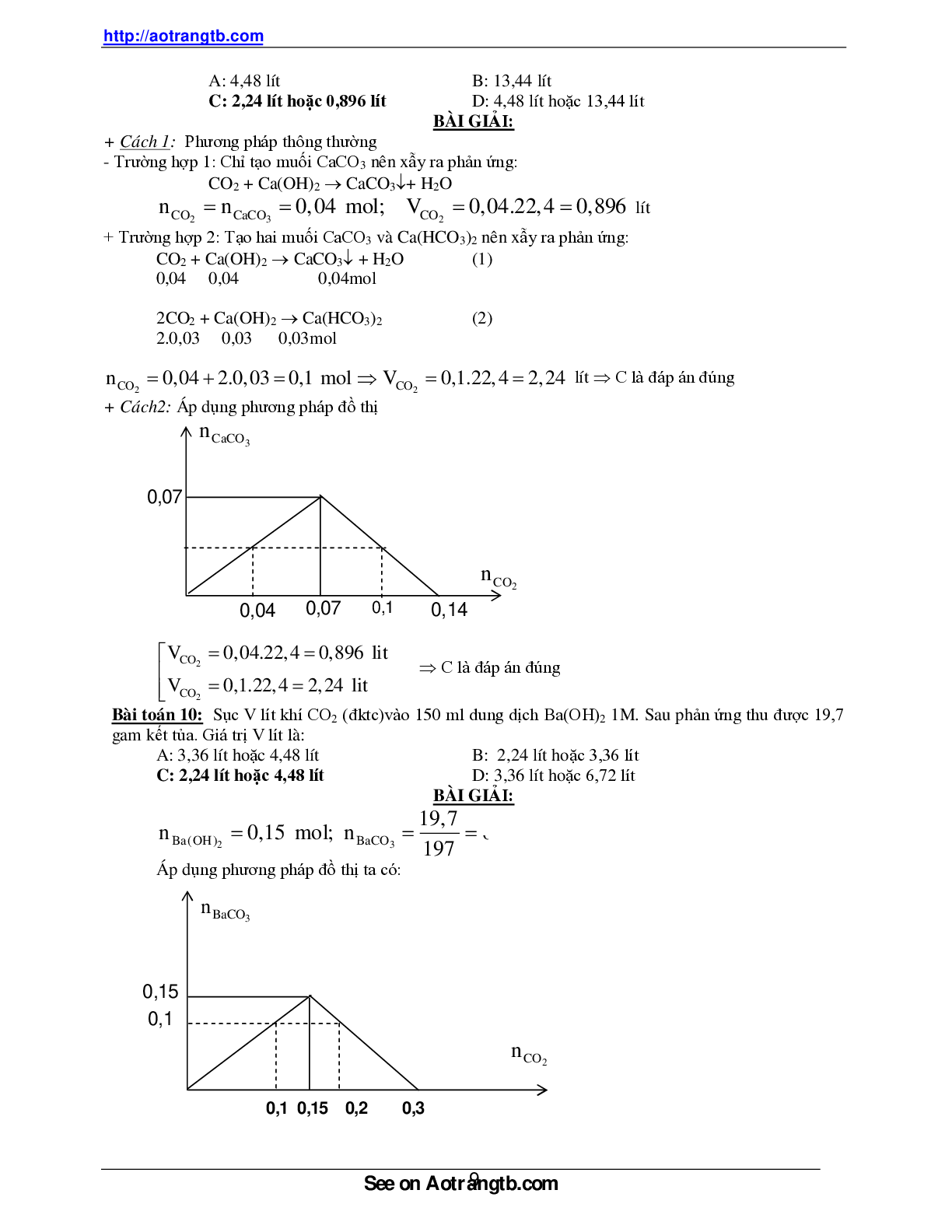
Sục a mol CO2 vào dung dịch Ca(OH)2 thu dược 3 gam kết tủa, lọc tách kết tủa dung dịch còn lại
mang đun nóng thu được 2 gam kết tủa nữa. Giá trị a mol là:
A: 0,05 mol B: 0,06 mol C: 0,07 mol D: 0,08 mol
BÀI GIẢI:
+ Cách 1: phương trình phản ứng có thể xãy ra:
CO2 + Ca(OH)2 CaCO3 + H2O (1)
2CO2 + Ca(OH)2 Ca(HCO3)2 (2)
Ca(HCO3)2 CaCO3 + CO2 + H2O (3)
Từ (1) =>
nCaCO3 0,03mol nCO2 nCaCO3 0,03mol
Từ (3) khi đun nóng
nCaCO3 0,02mol nCa(HCO )3 2 nCaCO3 0,02mol
Từ (2) =>
n CO2 2nCa(HCO )3 2 0,02.2 0,04mol, nCO2 0,04 0,03 0,07mol
đáp án đúng là C.
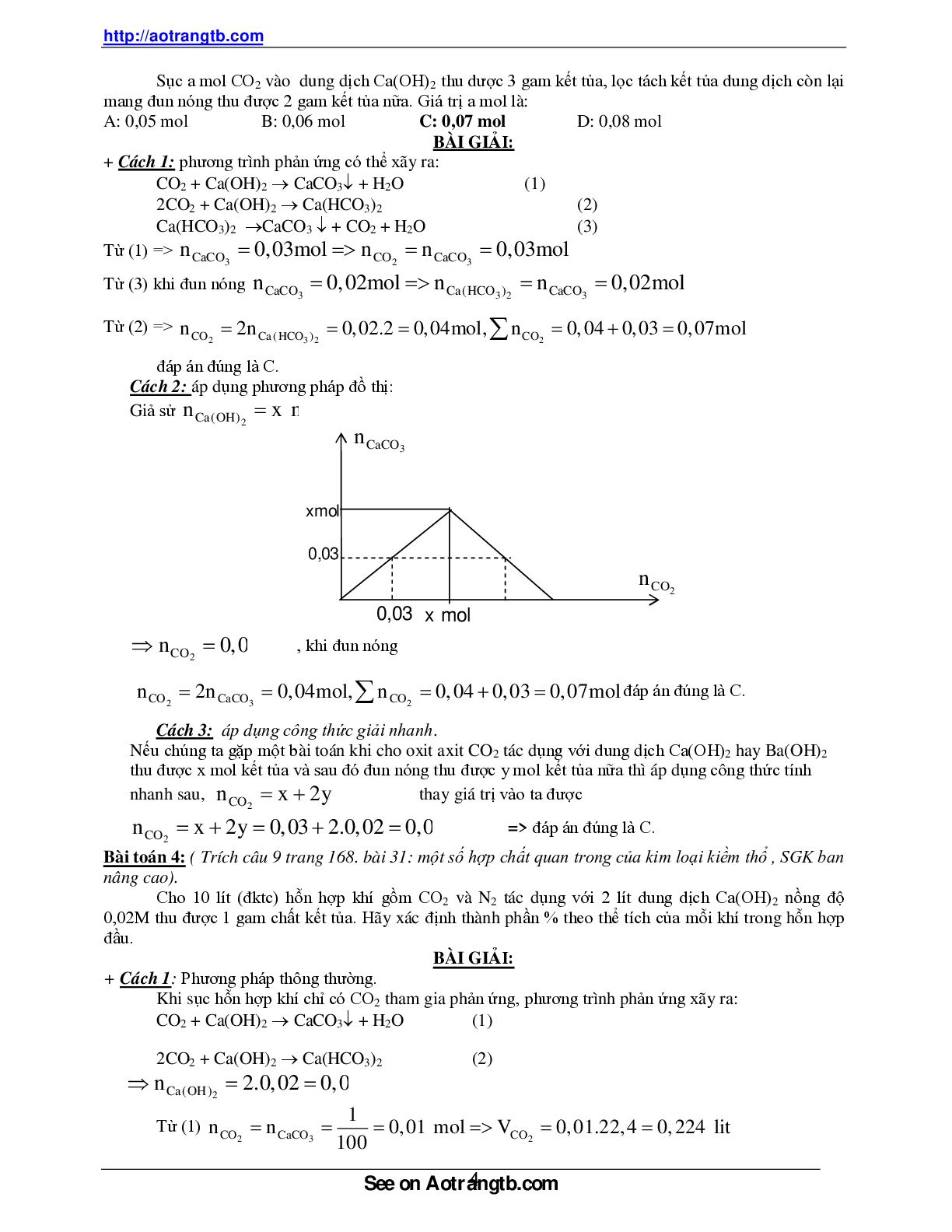
Cách 2: áp dụng phương pháp đồ thị:
Giả sử
nCa(OH)2 x mol
nCO2 0,03mol , khi đun nóng
nCO2 2n CaCO3 0,04mol, n CO2 0,04 0,03 0,07mol đáp án đúng là C.
Cách 3: áp dụng công thức giải nhanh.
Nếu chúng ta gặp một bài toán khi cho oxit axit CO2 tác dụng với dung dịch Ca(OH)2 hay Ba(OH)2
thu được x mol kết tủa và sau đó đun nóng thu được y mol kết tủa nữa thì áp dụng công thức tính
nhanh sau,
nCO2 x 2y thay giá trị vào ta được
nCO2 x 2y 0,03 2.0,02 0,07 mol => đáp án đúng là C.
Bài toán 4: ( Trích câu 9 trang 168. bài 31: một số hợp chất quan trong của kim loại kiềm thổ , SGK ban
nâng cao).
Cho 10 lít (đktc) hỗn hợp khí gồm CO2 và N2 tác dụng với 2 lít dung dịch Ca(OH)2 nồng độ
0,02M thu được 1 gam chất kết tủa. Hãy xác định thành phần % theo thể tích của mỗi khí trong hỗn hợp
đầu.
BÀI GIẢI:
+ Cách 1: Phương pháp thông thường.
Khi sục hỗn hợp khí chỉ có CO2 tham gia phản ứng, phương trình phản ứng xãy ra:
CO2 + Ca(OH)2 CaCO3 + H2O (1)
2CO2 + Ca(OH)2 Ca(HCO3)2 (2)
nCa(OH)2 2.0,02 0,04 mol
Từ (1)
CO2 CaCO3 CO2
1
n n 0,01 mol V 0,01.22,4 0,224 lit
100
nCaCO3
nCO2
xmol
0,03
2x
m
0,03 x mol
http://aotrangtb.com
See on Aotrangtb.com5
Có hai trường hợp xãy ra:
+ Trường hợp 1: Chỉ xãy ra phương trình (1)
CO2 + Ca(OH)2 CaCO3 + H2O (1)
CO2
%V 0,224 .100% 2,24%
10
+ Trường hợp 2: Tạo 2 muối
CO2 + Ca(OH)2 CaCO3 + H2O (1)
2CO2 + Ca(OH)2 Ca(HCO3)2 (2)
Từ (1) và (2)
tu(2) nCO2 2nCa(OH)2 2.0,03 0,06mol, nCO2 0,06 0,01 0,07mol
CO2
%V 0,07.22,4 .100 15,68 %
10
Kết luận: - Nếu %CO2=2,24 % => %N2=97,76 %
- Nếu %CO2=15,68 % => %N2=84,32 %
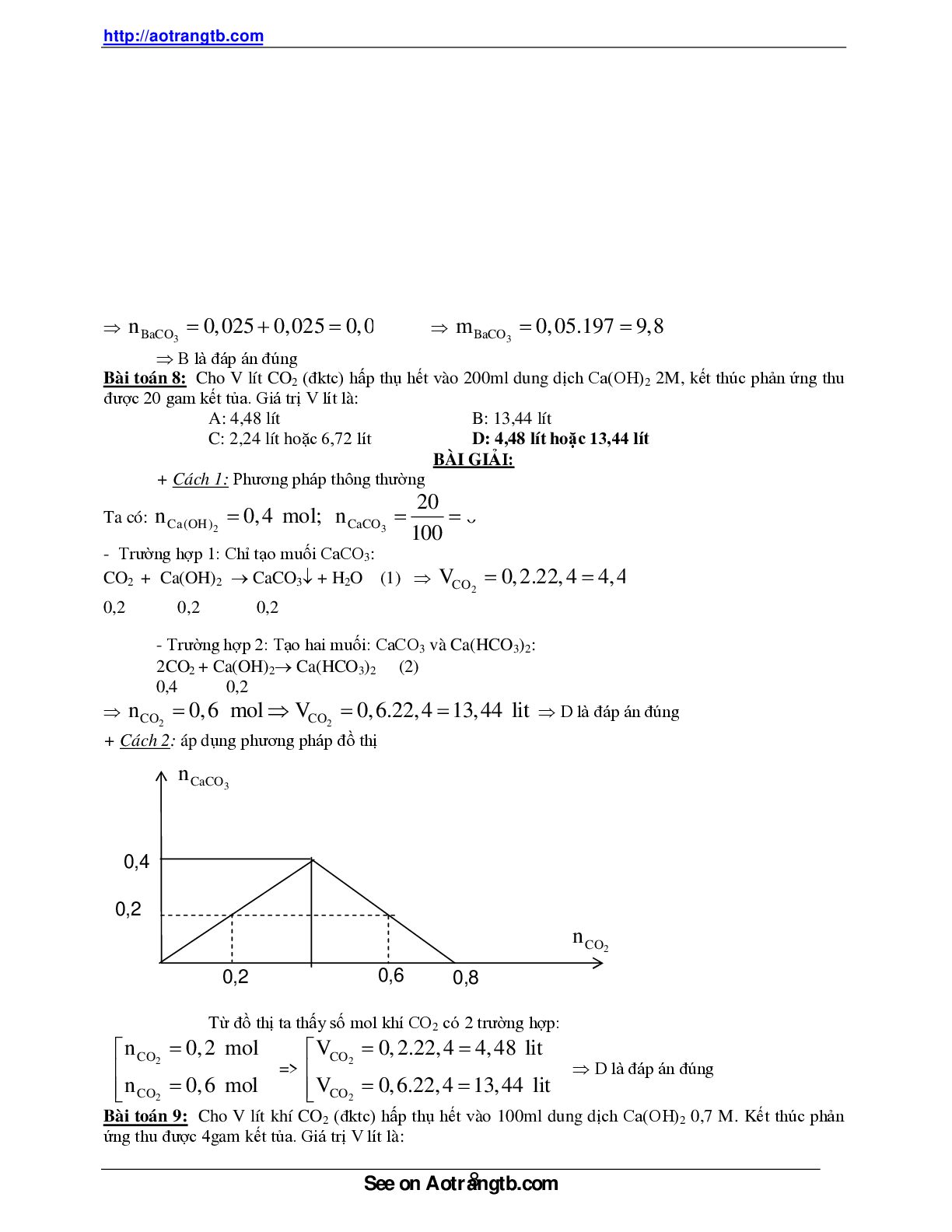
Cách 2: Áp dụng phương pháp đồ thị:
Từ đồ thị để thu được số mol CO2 có 2 giá trị:
2 2
2 2
CO CO
CO CO
n 0,01 mol %V 0,01.2,24 .100 2,24 %
10
n 0,07 mol %V 0,07.2,24 .100 15,68 %
10
Kết luận: - Nếu %CO2=2,24 % => %N2=97,76 %
- Nếu %CO2=15,68 % => %N2=84,32 %
Nhận xét: - Qua 2 cách giải ta thấy phương pháp thông thường giải phức tạp hơn nhiều, mất nhiều thời
gian, nếu không cẩn thận sẽ thiếu trường hợp , dẫn tới kết quả sai là không thể tránh khỏi.
- Phương pháp đồ thị giải nhanh và gon, không phải viết phương trình phản ứng, chỉ vẽ đồ thị ta
thấy có 2 trường hợp xãy ra, nó rất phù hợp với phương pháp trắc nghiệm như hiện nay.
Bài toán 5: ( Trích đề thi tốt nghiệp THPT năm 2007). Hấp thụ hoàn toàn 4,48 lít SO2 (ở đktc) vào dung
dịch chứa 16 gam NaOH thu được dung dịch X. Khối lượng muối tan thu được trong dung dịch X là:
A: 18,9 gam B: 25,2 gam C: 23 gam D: 20,8 gam
BÀI GIẢI:
+ Cách 1: Thông thường:
2
NaOH
SO
n
2
n
tạo muối Na2SO3
0,01
nCaCO3
nCO2
0,04
0,01
O 0,04 0,07 0,08
http://aotrangtb.com
See on Aotrangtb.com6
SO2 + 2NaOH Na2SO3 + H2O
0,2 0,4 0,2
mNa SO2 3 0,2.126 25,2 gam B là đáp án đúng
+ Cách 2: Áp dụng phương pháp đồ thị
0,2
Từ đồ thị: số mol của muối Na2SO3 = 0,2 mol. Nên ta có
mNa SO2 3 0,2.126 25,2 gam B là đáp án đúng
Bài toán 6: (Trích đề thi tuyển sinh Cao đẳng -Đại học Khối A năm 2007).
Hấp thụ hoàn toàn 2,688 lít CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mol/l thu được 15,76
gam kết tủa. Giá trị của a là:
A: 0,032 mol/l B: 0,06 mol/l C: 0,04 mol/l D: 0,048 mol/l
BÀI GIẢI:
+ Cách 1: Giải bằng phương pháp thông thường:
CO 2 BaCO 3
2,688 15,76
n 0,12 mol; n 0,08 mol
22,4 197
CO2 + Ba(OH)2 CaCO3+ H2O (1)
0,08 0,08 0,08 mol
2CO2 + Ba(OH)2 Ba(HCO3)2 (2)
0,04 0,02 mol
Từ (1) và (2)
nBa(OH)2 0,08 0,02 0,1mol
MBa (OH)2
C 0,1 0,04 M
2,5
C là đáp án đúng
+ Cách 2: Áp dụng phương pháp đồ thị ta có:
Na
2SO3
nSO2
0,4
0,2 0,4 0,8
n BaCO3
2,5 a
0,08
http://aotrangtb.com
See on Aotrangtb.com7
CO2 BaCO3
2,688 15,76
n 0,12 mol,n 0,08 mol
22,4 197
Ba(OH)2
n 2,5a mol 0,1mol a 0,1 0,04 mol / lit
2,5
C là đúng
Bài toán 7: (Trích đề thi tuyển sinh Cao đẳng -Đại học Khối A năm 2008). Hấp thụ hoàn toàn 4,48 lít
khí CO2 (ở đktc) vào 500 ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra m gam kết
tủa. Giá trị của m gam là:
A: 11,82 gam B: 9,85 gam C: 17,73 gam D: 19,70 gam
BÀI GIẢI:
+ Cách 1: Phương pháp thông thường
nCO2 0,2mol; n NaOH 0,5.0,1 0,05mol; n Ba(OH)2 0,5.0,2 0,1mol
2
OH
OH
CO
n
n 0,05 0,1.2 0,25mol; 1 1,25 2
n
tạo 2 muối
2 3
2
2 3 2
CO OH HCO (1)
x x x
CO 2OH CO H O (2)
y 2y y
x y 0,2
x 2y 0,25
3
23
x 0,15(HCO )
y 0,05(CO )
Phương trình tạo kết tủa là:
3
2 2
Ba CO3 BaCO3 mBaCO 0,05.197 9,85 gam
0,05 0,05
B là đúng
+Cách2: Áp dụng phương pháp đồ thị:
nCO2 0,2 mol,n NaOH 0,5.0,1 0,05 mol.n Ba(OH)2 0,5.0,2 0,1 mol
Ta có: CO2 + 2NaOH Na2CO3 + H2O
0,025 0,05 0,025mol
Như vậy:
nCO2d 0,175mol; n Na CO2 3 0,025mol; nBa(OH)2 0,1mol
n