Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Lý thuyết, bài tập về so sánh tính axit-bazo của các hợp chất hữu cơ môn Hóa học lớp 12, tài liệu bao gồm 11 trang, đầy đủ lý thuyết, phương pháp giải chi tiết và bài tập có đáp án (có lời giải), giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi tốt nghiệp THPT môn Hóa học sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
SO SÁNH TÍNH AXIT – BAZƠ CỦA CÁC HỢP CHẤT HỮU CƠ
Thạc sỹ: Nguyễn Cao Chung
GV trường THPT Kỹ Thuật Lệ Thủy – Quảng Bình
I- KHÁI NIỆM
1. Định nghĩa axit – bazơ:
- Theo Bronstet-Lawry: Axit là chất cho proton, bazo là chất nhận proton.
- Theo Lewwis: Axit là chất nhận cặp electron, bazơ là chất cho cặp electron.
2. Tính axit của các hợp chất hữu cơ.
Mọi yếu tố làm tăng khả năng phân ly của liên kết O – H và làm tăng độ bền của anion
sinh ra đều làm tăng tính axit, tức là làm tăng Ka hay làm giảm pKa (pKa = – lgKa , đối
với cặp axit-bazơ liên hợp thì pKa + pKb =14)
- Trong nhóm cacboxyl -COOH có hiệu ứng liên hợp p - nên làm giảm mật độ e ở
nguyên tử oxi trong nhóm OH liên kết O – H bị phân cực mạnh.
- Các nhóm ankyl có hiệu ứng (+I) nên cản trở sự di chuyển e về phía C = O, làm tăng
mật độ e ở nguyên tử oxi trong nhóm OH, giảm sự phân cực của liên kết O – H làm
giảm tính axit.
- Các nhóm hút e như Cl, Br, NO2… có hiệu ứng (- I) nên hỗ trợ sự di chuyển e về
phía C = O làm giảm mật độ e ở nguyên tử oxi trong nhóm OH, tăng sự phân cực của
liên kết O – H làm tăng tính axit.
2.1. Khi giải thích tính axit cần giải thích hiệu ứng ở trạng thái chưa phân li và cả
trạng thái đã phân li.
Ví dụ: HA + H2O H3O+ + A-
- Trạng thái tĩnh: Phân tử càng dễ phân li thành H+ thì tính axit càng mạnh tức là
nguyên tử hiđro gây tính axit càng linh động thì càng dễ phân li.
- Trạng thái động: (khi tạo ra bazơ liên hợp), anion mà càng bền tức điện tích âm được
giải toả càng nhiều thì tính axit càng mạnh.
Kết hợp 2 yếu tố đó sẽ kết luận được tính axit của chất đó.
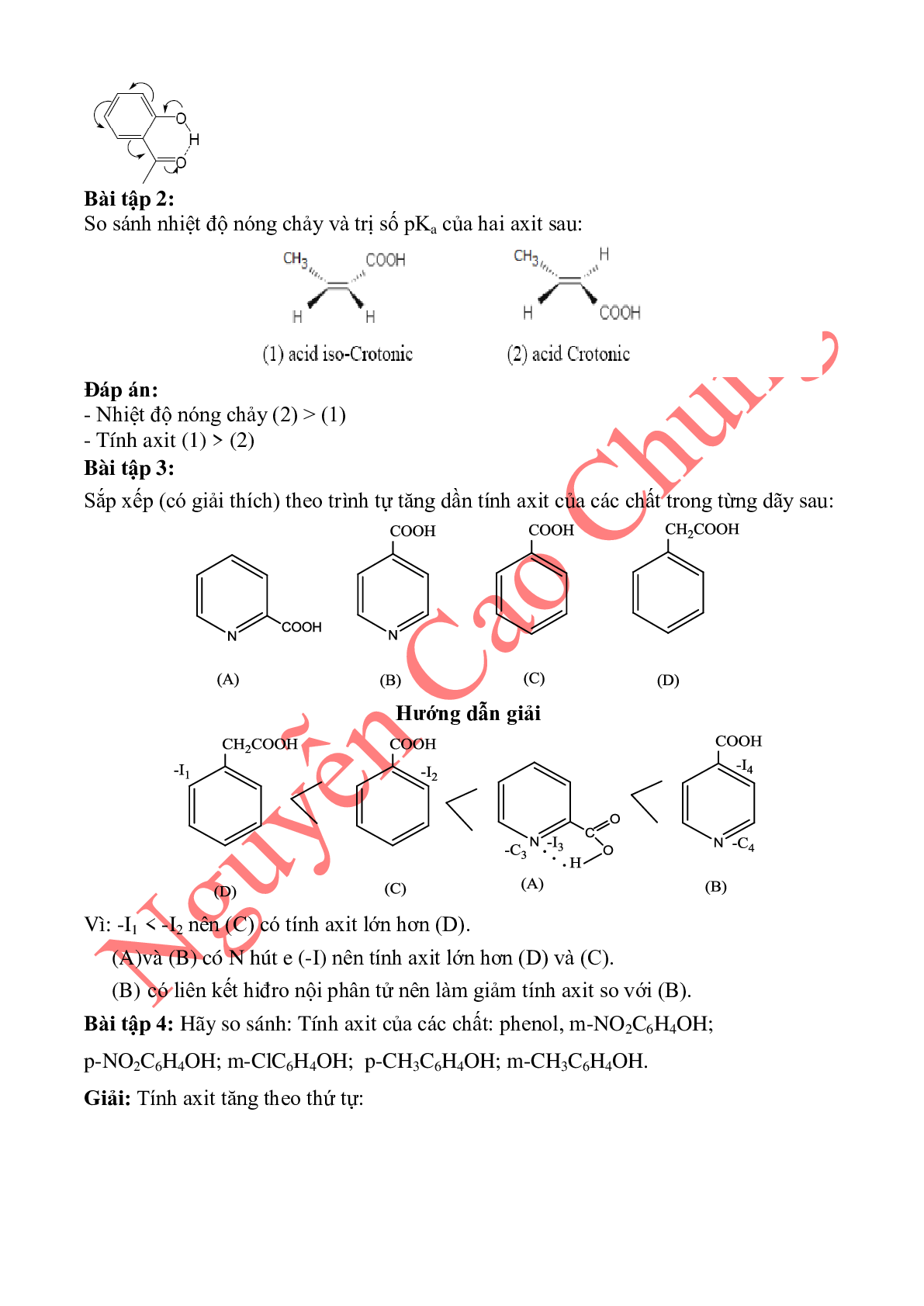
Ví dụ: Xét tính axit của C2H5OH, C6H5OH, CH3COOH.
C H O H 2 5
C H 2 5 + H2O O- + H3O+ (1)
+ I + I
–H + H2O + H3O+ (2)
–C, –I –C, –I
+ H2O ≡ + H3O+ (3)
O OCH
3 C
O
O
CH3 C O H O
CH3 C
12
O
12
O
–C, –I
Nhận xét: Độ bền của các ion ở (1) < (2) < (3) do đó tính axit của
C2H5OH < C6H5OH < CH3COOH.
2.2. Trong bất kì trường hợp nào, nếu có nhóm thế hút e sẽ làm cho tính axit tăng.
Ngược lại, nếu có nhóm thế đẩy e sẽ làm cho tính axit giảm.
Ví dụ: Tính axit của các chất tăng dần trong dãy sau:
CH3CH2CH2–COOH < CH3CHBrCH2–COOH < CH3CH2CHBr–COOH <
< CH3CHICHBr–COOH < CH3CHBrCHBr–COOH.
2.3. Tính axit của axit không no và axit thơm lớn hơn axit no tương ứng.
Ví dụ 1: Tính axit tăng dần theo dãy sau:
CH3CH2CH2–COOH < CH3CH=CH–COOH < CH3C≡C–COOH.
- Các liên kết kép C = C hay C C có hiệu ứng (-I) sẽ làm tăng tính axit (trong đó liên
kết C C có hiệu ứng (-I) mạnh hơn, do độ âm điện của C lai hóa sp > độ âm điện của
C lai hóa sp2).
- Trạng thái lai hoá của cacbon ảnh hưởng tới hiệu ứng cảm ứng. Độ âm điện của các
Csp > Csp 2 > C cacbon lai hoá giảm như sau: sp 3
Ví dụ 2: Tính axit của
>
Trong axit chứa liên kết đôi C=C thì tính axit của dạng cis > tính axit của dạng trans.
<
+C tăng làm Ka giảm Do hiệu ứng không gian loại II nên
+C giảm làm Ka tăng
pKa-trans =4,68 pKa-cis = 4,38
2.4. Các dạng axit , không no có tính axit yếu hơn dạng , không no.
Ví dụ: Tính axit:
<
– I và + C chỉ có – I
CH3CH=CH-CH2COOH ,pKa = 4,48 > CH2=CH-CH2CH2COOH, pKa=4,68 >
CH3CH2CH=CH-COOH pKa = 4,83
2.5. Axit thơm R-C6H4-COOH
I - Ở vị trí para các nhóm thế gây ra hiệu ứng cảm ứng ; hiệu ứng liên hợp và siêu
H liên hợp ( C, ) phát huy được tác dụng (ảnh hưởng trực tiếp)
I - Ở vị trí meta các nhóm thế chủ yếu gây hiệu ứng cảm ứng , hiệu ứng liên hợp và
H siêu liên hợp ( C, ) hầu như không phát huy được tác dụng (ảnh hưởng gián tiếp)
C C O O O O H H
CH
3
C
C C
H O
OH
H
CH
3 C
C C
H
O
OH
H
C = O
CH C C3
O O H H
CH CH CH C O2 2
- Các axit đồng phân ortho RC6H4COOH có tính axit luôn lớn hơn các đồng phân khác
bất kể bản chất của các nhóm thế là gì (hút hay đẩy e) . Loại ảnh hưởng đặc biệt của các
nhóm thế ở vị trí ortho như vậy gọi là hiệu ứng ortho (hiệu ứng cảm ứng, không gian,
hiệu ứng trường và liên kết hidro)
- Các nhóm thế ở vị trí meta và para của axit benzoic làm thay đổi tính axit theo qui
luật: các nhóm thế có hiệu ứng +I,+C hay +H (đẩy electron) luôn làm giảm tính axit,
các nhóm thế có hiệu ứng –I,-C (hút electron) luôn làm tăng tính axit.
- Hai nhóm thế -NO2, -CN ở vị trí para thì cả hai hiệu ứng –I, -C đều phát huy được tác
dụng cho nên tính axit tăng hơn vị trí meta, ở vị trí mêta các nhóm thế này chỉ có hiệu
ứng –I, còn hiệu ứng –C không phát huy được tác dụng. Ngoài cách dựa vào hiệu ứng
để giải thích tính axit còn có thể dựa vào độ ổn định của anion cacboxylat, khi các
nhóm thế này ở vị trí para sẽ ổn định hơn ở vị trí meta.
- Đối với nhóm –OH, -OR thì ở vị trí para chúng phát huy được cả hai hiệu ứng –I và
+C (+C>-I) nên tính axit giảm . Khi các nhóm thế này ở vị trí meta, chúng chỉ có hiệu
ứng –I nên tính axit tăng.
- Các halogen (F,Cl,Br,I) gắn vào nhân bezen có –I,+C (-I>+C) .Ở vị trí mêta chúng chỉ
có hiệu ứng –I nên tính axit tăng, còn ở vị trí para hiệu ứng –I mạnh hơn +C nên làm
cho tính axit giảm hơn vị trí meta
- Hầu hết các nhóm +C đồng thời có cả hiệu ứng –I , nên thể hiện một hiệu ứng tổng
quát bao gồm cả hai loại hiệu ứng đó. Ví dụ: CH3O- là nhóm đẩy electon nói chung (+C
mạnh hơn -I), nhưng Cl- lại là nhóm hút electron nói chung (+C yếu hơn -I).
R pKa (para) pKa (meta) pKa (ortho)
-NO2 3,43 (-C, -I) 3,49 (-I) 2,17
-CN 3,55(-C, -I) 3,84(-I) 3,14
-F 4,14 (+C<-I) 3,87 (-I) 3,27
-OH 4,54 (-I<+C) 4,08 (-I) 2,98
-CH3 4,37(+I,+H) 4,27(+I) 3,91
-NH2 4,92(-I<+C) 4,78 (-I) 3,91
-OCH3 4,54 (-I<+C) 4,09 (-I) 4,09
pKa càng nhỏ tính axit càng mạnh.
3. Tính bazơ của các chất hữu cơ.
3.1. Giải thích tính bazơ của các chất cần chú ý ở trạng thái đầu và các trạng thái
tạo ra cation.
-Trạng thái tĩnh: Các amin mật độ e trên nguyên tử nitơ càng lớn thì tính ba zơ càng
mạnh
-Trạng thái động: Ion sinh ra bền, càng dễ bị sonvat hoá thì điện tích dương được giải
toả càng nhiều thì tính bazơ càng mạnh.
Kết hợp 2 yếu tố đó sẽ kết luận được tính bazơ của chất đó.
Ví dụ: Xét tính bazơ của NH3, CH3–NH2 và CH3–NH–CH3.
NH4 NH3 + H2O + OH- (1)
N H 3 CH3-NH2 + H2O CH3 + OH- (2)
+I +I
N H 2 CH3-NH-CH3 + H2O CH3- -CH3 + OH- (3)
+I mạnh +I mạnh
N H N H NH 4 2 3 Vì độ bền các cation giảm theo chiều: CH3- -CH3 > CH3- > nên
tính bazơ của CH3–NH–CH3 > CH3–NH2 > NH3.
3.2. Trong phân tử nếu có chứa nhóm đẩy e sẽ làm tăng tính bazơ, ngược lại
nhóm hút e sẽ làm giảm tính bazơ của hợp chất.
Ví dụ: Tính bazơ giảm dần theo chiều:
CH3– CH2 -NH2 > CH3 -NH2 > NH3 > C6H5 -NH2 > C6H5 – NH- C6H5
3.3. Với amin no, trong dung dịch nước, tính bazơ của amin bậc 3 < bậc 2 > bậc 1
Sự hơn kém tính bazơ của amin bậc 1 và bậc 3 tùy thuộc gốc hidrocacbon
(CH3)2NH > CH3NH2> (CH3)3N (C2H5)2NH > (C2H5)3N > C2H5NH2
pKa: 10,77 10,63 9,8
pKb: 3,23 3,38 4,20 3,07 3,13 3,33
- Tính bazơ của amin bậc 3 nhỏ hơn amin bậc 2 vì khả năng sonvat hoá của ion
triankylamôni yếu hơn ion điankyl amoni, do số nguyên tử H ở amin bậc 3 ít hơn, mặt
khác do ảnh hưởng không gian của 3 gốc ankyl
R R
R- N+ - H .... OH2 < R – N+ - H .... OH2
R H...OH2
- Trong dung môi không phân cực (benzen, hexan): bậc 3> bậc 2 > bậc 1
- Amin no bậc 2, dạng vòng có tính bazơ > dạng mạch hở.
Do (2) sự án ngữ không gian của hai nhóm R và R’ nên khả năng hiđrat hóa yếu hơn =>
điện tích dương ít được giải tỏa hơn nên kém bền hơn.
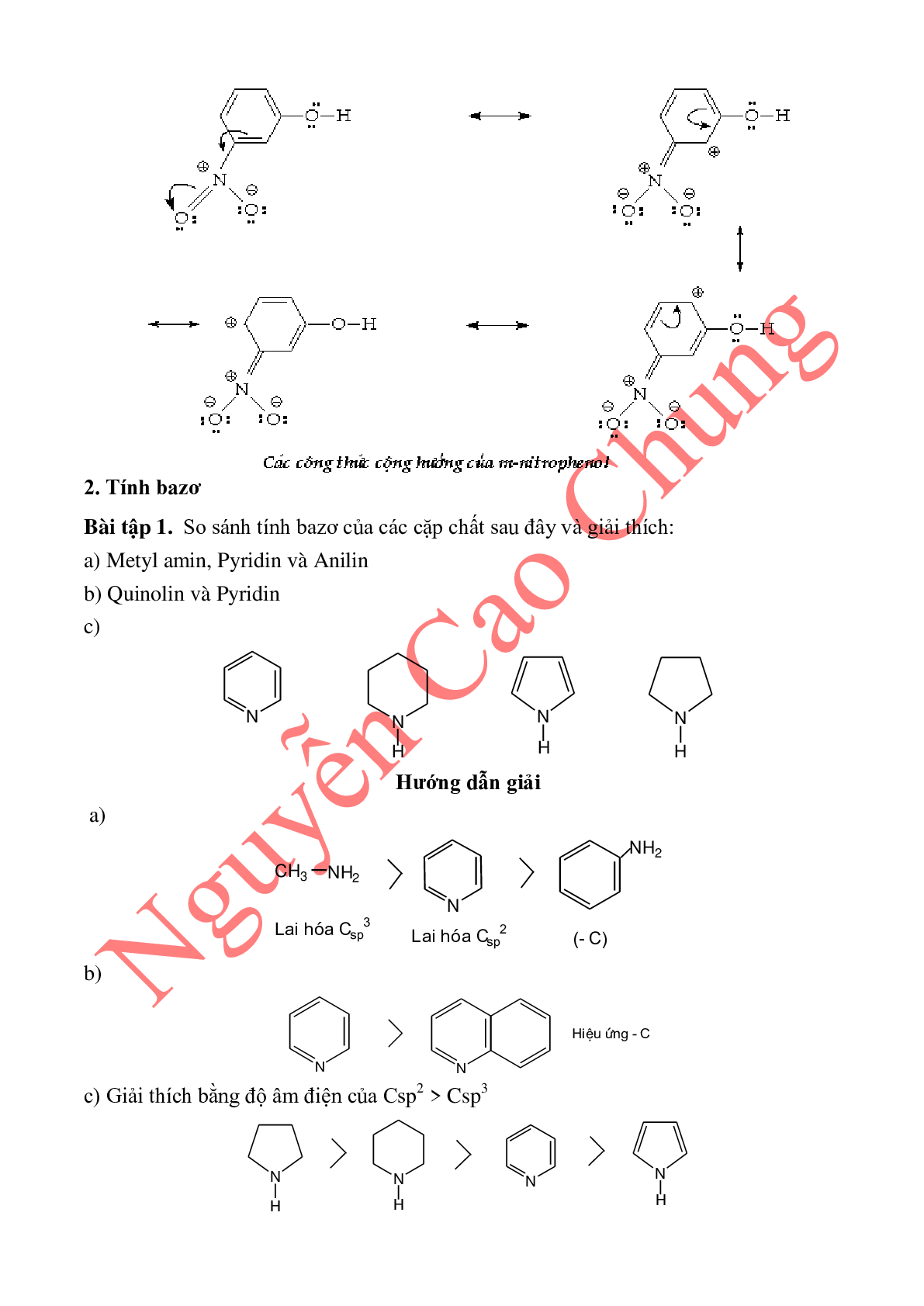
3.4. Tính bazơ của amin dị vòng no lớn hơn amin dị vòng thơm.
Ví dụ: Tính bazơ giảm dần theo chiều:
> >
sp3 sp2 cặp e tự do trên N tham gia liên hợp
NH
3.5. Amin thơm có bậc càng cao thì tính bazơ càng giảm (do cặp e cuả N đã tham
gia liên hợp với vòng benzen hay hiệu ứng –C tăng).
Hầu hết amin thơm có nhóm thế dù hút hay đẩy electron ở vị trí ortho thường làm
giảm tính bazơ so với amin thơm có nhóm thế ở vị trí para và meta. Nguyên nhân là do
hiệu ứng trường của nhóm thế ở vị trí ortho (hiệu ứng ortho)
Ví dụ: Tính bazơ của các hợp chất thơm có các nhóm thế ở các vị trí khác nhau
trong hợp chất có công thức tổng quát : X-C6H4-NH2 đo được như sau: (pKa càng lớn
tính ba zơ càng mạnh.)
Câu 1: Cho 4 axit CH3COOH (X), Cl2CHCOOH (Y), ClCH2COOH (Z), BrCH2COOH (T). Chiều tăng dần tính axit của các axit trên là :
A. T, Z, Y, X B. X, Z, T, Y C. X, T, Z, Y D. Y, Z, T, X
TL : C. X, T, Z, Y
Câu 2: Sắp xếp các chất sau đây theo trình tự giảm dần nhiệt độ sôi:
CH3COOH (1), HCOOCH3 (2), CH3CH2COOH (3),CH3COOCH3 (4), CH3CH2CH2OH (5).
A. (3) > (1) > (4) > (5) > (2). B. (1) > (3) > (4) > (5) > (2).
C. (3) > (1) > (5) > (4) > (2). D. (3) > (5) > (1) > (2) > (4).
TL:
C. (3) > (1)(vì cùng nhóm chức nhưng M(3)>M(1)) > (5)(lk H của (5)kém linh động hơn) > (4) > (2)(Vì cùng nhóm chức nhưng M(4)>M(2)).
Câu 3: Cho các chất sau: (1) Anilin ;(2) etylamin ;(3) điphenylamin ; (4) đietylamin ;(5) natrihidroxit ; (6)Amoniăc . Dãy nào sau đây có thứ tự sắp xếp theo chiều giảm dần tính bazơ của các chất ?
A. (5) > (4) > (2) > (6) > (1) > (3) B. (6) > (4) > (3) > (5) > (1) > (2)
C. (5) > (4) > (2) > (1) > (3) > (6) D. (1) > (3) > (5) > (4) > (2) > (6)
TL: A. (5) > (4) > (2) > (6) > (1) > (3)
Câu 4: Dãy gồm các chất được xếp theo chiều giảm dần lực bazơ theochiều từ trái sang phải là:
A. (C6H5)2NH, C6H5NH2, NH3, C2H5NH2, (C2H5)2NH, NaOH.
B. C6H5NH2, (C6H5)2NH, NaOH, (C2H5)2NH, C2H5NH2, NH3.
C. NaOH, (C2H5)2NH, C2H5NH2, NH3, C6H5NH2, (C6H5)2NH.
D. NaOH, (C2H5)2NH, C2H5NH2, C6H5NH2, (C6H5)2NH, NH3.
TL
C:NaOH, (C2H5)2NH, C2H5NH2, NH3, C6H5NH2,(C6H5)2NH.
Câu 5: Thứ tự các chất xếp theo chiều tăng dần lực axit là
A. HCOOH<CH3COOH<CH3CHClCOOH<CH2ClCH2COOH.
B. CH2ClCH2COOH<CH3CHClCOOH<CH3COOH<HCOOH
C. HCOOH<CH3COOH<CH2ClCH2COOH<CH3CHClCOOH.
D. CH3COOH<HCOOH<CH2ClCH2COOH<CH3CHClCOOH.
TL:
D:CH3COOH<HCOOH<CH2ClCH2COOH<CH3CHClCOOH