Thuốc thử dùng để nhận biết dung dịch HCl và dung dịch là:
A. K2SO4
B. Ba(OH)2
C. NaCl
D. NaNO3
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án: B
HCl phản ứng với Ba(O không có hiện tượng còn xuất hiện kết tủa trắng
Lý thuyết Sulfuric acid
a) Tính chất vật lý và cấu tạo phân tử:
- Là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp 2 lần nước (H2SO4 98% có D = 1,84g/cm3).
- Trong phân tử của H2SO4, các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị. 2 liên kết đơn O – H, 2 liên kết đơn O – S và 2 liên kết đôi S = O.
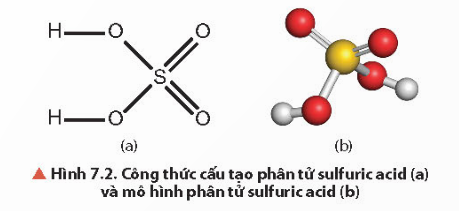
b) Tính chất hóa học và ứng dụng
- Dung dịch H2SO4 loãng có tính chất chung của acid như:
+ Làm quỳ tím hóa đỏ
+ Tác dụng với kim loại
+ Tác dụng với basic oxide và base
+ Tác dụng với muối
-Dung dịch H2SO4 đặc, nóng có tính oxi hóa mạnh và tính háo nước
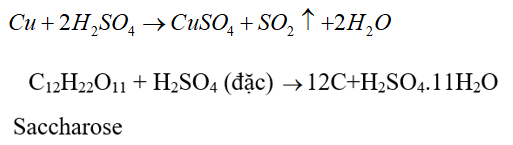
- Ứng dụng
+ Sulfuric acid đặc hấp thụ mạnh hơi nước nên được dùng để làm khô những khí không tác dụng với nó.
+ Dùng để sản xuất phân bón, thuốc trừ sâu, chất tẩy rửa tổng hợp, tơ sợi hóa học, chất dẻo…
c) Cách bảo quản, sử dụng và nguyên tắc xử lí khi bỏng acid
- Khi sử dụng, bảo quản dung dịch sulfuric acid cần phải cẩn thận, tuân thủ đúng nguyên tắc an toàn.
- Cách pha loãng dung dịch H2SO4 đặc: đổ từ từ dung dịch H2SO4 đặc vào nước, tuyệt đối không làm ngược lại.
- Khi bị bỏng acid cần nhanh chóng bỏ quần áo bị dính acid, rửa ngay bằng nước sạch khoảng 20 phút sau đó đến cơ sở ý tế gần nhất.
d) Quy trình sản xuất sulfuric acid theo phương pháp tiếp xúc
- Giai đoạn 1: Sản xuất SO2:
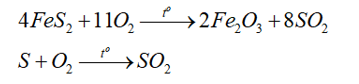
- Giai đoạn 2: Sản xuất SO3
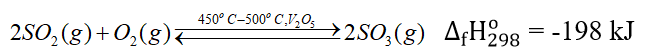
- Giai đoạn 3: Sản xuất H2SO4
Xem thêm một số kiến thức liên quan:
Lý thuyết Sulfuric acid và muối sulfate (Chân trời sáng tạo) hay, chi tiết | Hóa học 11
15 câu Trắc nghiệm Sulfuric acid và muối sulfate (Chân trời sáng tạo) có đáp án – Hóa học lớp 11
Một loại nguyên tử nitrogen có 7 proton và 7 neutron trong hạt nhân. Dựa vào Bảng 1.1, hãy tính và so sánh:
a) Khối lượng hạt nhân với khối lượng nguyên tử.
b) Khối lượng hạt nhân với khối lượng vỏ nguyên tử.
Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hóa học vì nó cho biết:
Kim loại nào sau đây phản ứng được với dung dịch FeSO4 và dung dịch HNO3 đặc, nguội?
Methanol (CH3OH) là nguyên liệu quan trọng trong công nghiệp hoá học. Dựa vào hằng số cân bằng của các phản ứng ở 25 oC, hãy lựa chọn phản ứng thích hợp để điều chế CH3OH. Giải thích.
CO(g) + 2H2(g) ⇌ CH3OH(g) KC = 2,26.104 (1)
CO2(g) + 3H2(g) ⇌ CH3OH(g) + H2O(g) KC = 8,27.10-1 (2)
Trong các nguyên tố sau, nguyên tử của nguyên tố có bán kính lớn nhất là:
Nguyên tử clo (chlorine) có điện tích hạt nhân là +17. Số proton và số electron trong nguyên tử này là
Kim loại nào sau đây phản ứng dung dịch CuSO4 tạo thành 2 chất kết tủa?
Khi cho dung dịch NaOH vào dung dịch NH4Cl, đun nóng thì thấy thoát ra:
Lên men 1 tấn tinh bột chứa 5% tạp chất trơ thành ancol etylic, hiệu suất mỗi quá trình lên men là 85%. Khối lượng ancol thu được là: