Tailieumoi.vn giới thiệu Giải bài tập hóa học 8 Bài 16: Phương trình hóa học, chi tiết nhất giúp học sinh dễ dàng làm bài tập Phương trình hóa học lớp 8.
Giải bài tập Hóa học lớp 8 Bài 16: Phương trình hóa học
Câu hỏi và bài tập (trang 57, 58 sgk Hóa học lớp 8)
b) Sơ đồ của phản ứng khác với phương trình hóa học của phản ứng ở điểm nào?
c) Nêu ý nghĩa của phương trình hóa học.
Lời giải:
a) Phương trình hóa học là phương trình biểu diễn ngắn gọn phản ứng hóa học, gồm công thức hóa học của chất tham gia phản ứng và sản phẩm.
b) Sơ đồ phản ứng khác với phương trình hóa học là chưa có hệ số thích hợp, tức là chưa cân bằng số nguyên tử. Tuy nhiên cũng có một số sơ đồ phản ứng cũng chính là phương trình hóa học.
c) Ý nghĩa: Phương trình hóa học cho biết tỉ lệ về số nguyên tử, số phân tử giữa các chất cũng như từng cặp chất trong phản ứng.
a) Na + O2 ---> Na2O
b) P2O5 + H2O ---> H3PO4
Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phản ứng.
Lời giải:
a) Phương trình hóa học: 4Na + O2 2Na2O
Số nguyên tử Na : Số phân tử O2 : Số phân tử Na2O = 4 : 1 : 2
b) Phương trình hóa học: P2O5 + 3H2O 2H3PO4
Số phân tử P2O5 : Số phân tử H2O : Số phân tử H3PO4 = 1 : 3 : 2
a) HgO ---> Hg + O2
b) Fe(OH)3 ---> Fe2O3 + H2O
Lời giải:
a) Phương trình hóa học: 2HgO ->2 Hg + O2
Số phân tử HgO : Số nguyên tử Hg : Số phân tử O2 = 2 : 2 : 1
b) Phương trình hóa học: 2Fe(OH)3 -> Fe2O3 + 3H2O
Số phân tử Fe(OH)3 : Số phân tử Fe2O3 : Số phân tử H2O = 2 : 1 : 3
Na2CO3 + CaCl2 ---> CaCO3 + NaCl
a) Lập phương trình hóa học của phản ứng.
b) Cho biết tỉ lệ số phân tử của 4 cặp chất trong phản ứng (tùy chọn).
Lời giải:a) Phương trình hóa học: Na2CO3 + CaCl2 -> CaCO3 + 2NaCl
b) Tỉ lệ số phân tử của các cặp chất trong phản ứng:
Natri cacbonat : canxi clorua là 1:1
Canxi cacbonat : natri clorua là 1:2
Canxi clorua : natri clorua là 1:2
Natri cacbonat : canxi cacbonat là 1:1
a) Lập phương trình hóa học của phản ứng.
b) Cho biết tỉ lệ số nguyên tử Mg lần lượt với số phân tử của ba chất khác trong phản ứng.
Lời giải:a) Phương trình hóa học phản ứng:
Mg + H2SO4 → MgSO4 + H2
b) Ta có tỉ lệ:
Nguyên tử magie : phân tử axit sunfuric = 1 : 1
Nguyên tử magie : phân tử hiđro = 1 : 1
Nguyên tử magie : phân tử magie sunfat = 1 : 1
a) Lập phương trình hóa học của phản ứng.
b) Cho biết tỉ lệ số nguyên tử P lần lượt với số phân tử của hai chất khác trong phản ứng.
Lời giải:a) Phương trình hóa học của phản ứng :
4P + 5O2 -> 2 P2O5
b) Ta có tỉ lệ:
Số nguyên tử P : Số phân tử O2 = 4 : 5
Số nguyên tử P : Số phân tử P2O5 = 4 : 2 = 2
a) ?Cu + ? → 2CuO
b) Zn + ?HCl → ZnCl2 + H2
c) CaO + ?HNO3 → Ca(NO3)2 + ?
Lời giải:
a) 2Cu + O2→ 2CuO
b) Zn + 2HCl → ZnCl2 + H2
c) CaO + 2HNO3 → Ca(NO3)2 + H2O
I. Định nghĩa
- Phương trình hóa học là phương trình biểu diễn ngắn ngọn phản ứng hóa học.
Ví dụ: Phương trình chữ của phản ứng hóa học giữa khí hiđro và khí oxi tạo ra nước là:
Khí hiđro + khí oxi → nước
- Thay tên các chất bằng công thức hóa học được sơ đồ của phản ứng:
H2 + O2 ---> H2O
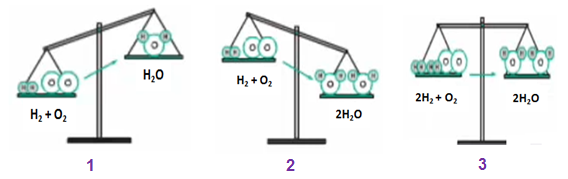
- Ở hình 1: Nếu theo sơ đồ phản ứng: H2 + O2 ---> H2O thì
+ Vế trái có 2 nguyên tử H và 2 nguyên tử O
+ Vế phải có 2 nguyên tử H và 1 nguyên tử O
=> vế trái có khối lượng lớn hơn vì hơn 1 nguyên tử O
- Ở hình 2: Nếu vế trái nhiều hơn 1 nguyên tử O thì ta thêm hệ số 2 trước vế phải, lúc này:
+ Vế trái: 2 nguyên tử H và 2 nguyên tử O
+ Vế phải: 4 nguyên tử H và 2 nguyên tử O
=> vế phải có khối lượng lớn hơn, do hơn 2 nguyên tử H
- Ở hình 3: ta thêm hệ số 2 vào trước H2 và H2O
+ Vế trái: 4 nguyên tử H và 2 nguyên tử O
+ Vế phải: 4 nguyên tử H và 2 nguyên tử O
=> khối lượng của 2 vế bằng nhau, số nguyên tử của mỗi nguyên tố đã bằng nhau
Phương trình hóa học của phản ứng viết như sau:
II. Các bước lập phương trình hóa học
Bước 1: Viết sơ đồ phản ứng, gồm công thức hóa học của chất tham gia, sản phẩm.
Bước 2: Cân bằng số nguyên tử mỗi nguyên tố: tìm hệ số thích hợp đặt trước các công thức sao cho số nguyên tử các nguyên tố ở chất tham gia và chất tạo thành là bằng nhau.
Bước 3: Viết thành phương trình hóa học.
Chú ý:
- Không được thay đổi các chỉ số trong công thức hóa học đã viết đúng. Ví dụ như 3O2 (đúng) chuyển thành 6O (sai)
- Viết hệ số cao bằng kí hiệu hóa học. Ví dụ: 2Al, 3Fe (đúng), không viết là 2Al, 3Fe
- Trong các công thức hóa học có các nhóm nguyên tử như OH, SO4,… thì coi cả nhóm như 1 đơn vị để cân bằng, trước và sau phản ứng số nhóm nguyên tử phải bằng nhau.
Ví dụ: Lập phương trình hóa học cho phản ứng hóa học sau: photpho + oxi → điphotpho pentaoxit (P2O5)
Hướng dẫn:
Bước 1: Sơ đồ của phản ứng: P + O2 ---> P2O5
Bước 2: Đặt hệ số thích hợp trước từng công thức. Ta thấy số nguyên tử P và O đều không bằng nhau, nhưng nguyên tố oxi có số nguyên tử nhiều hơn. Ta bắt đầu từ nguyên tố này. Trước hết làm chẵn số nguyên tử O ở bên phải, đặt hệ số 2 trước P2O5 ta được:
P + O2 ---> 2P2O5
Bên trái cần có 4P và 10O hay 5O2, các hệ số 4 và 5 là thích hợp
Bước 3: Viết phương trình hóa học: 4P + 5O2 → 2P2O5
III. Ý nghĩa phương trình hóa học
- Phương trình hóa học cho ta biết tỉ lệ về số nguyên tử, số phân tử giữa các chất cũng như từng cặp chất trong phản ứng. Tỉ lệ này bằng đúng tỉ lệ hệ số mỗi chất trong phương trình.
Ví dụ: Trong phương trình phản ứng: 4P + 5O2 → 2P2O5
Tỉ lệ số nguyên tử P : số phân tử O2 : số phân tử P2O5 = 4 : 5 : 2
Sơ đồ tư duy: Phương trình hóa học

Phương pháp cân bằng một số phương trình hóa học
1. Các bước cân bằng phương trình hóa học:
Bước 1: Viết sơ đồ phản ứng, gồm công thức hóa học của các chất tham gia sản phẩm.
Bước 2: Cân bằng số nguyên tử mỗi nguyên tố: tìm hệ số thích hợp đặt trước công thức.
Bước 3: Viết thành phương trình hóa học.
2. Một số ví dụ điển hình
Ví dụ 1: Cân bằng phương trình hóa học sau đây:
Fe + HCl ---> FeCl2 + H2
Lời giải:
Bước 1:
Fe + HCl ---> FeCl2 + H2 (1)
Bước 2:
(1) VP có chứa 2 nguyên tử Cl => Thêm 2 vào phân tử HCl
Bước 3:
Ta có phương trình hoàn chỉnh:
Fe + 2HCl--> FeCl2 + H2
Ví dụ 2: Cân bằng phương trình hóa học sau đây:
CaCO3 + HCl --> CaCl2 + CO2 + H2O (2)
Lời giải:
Bước 1:
CaCO3 + HCl --> CaCl2 + CO2 + H2O
Bước 2:
(2) VP có chứa 2 nguyên tử Cl => Thêm 2 vào phân tử HCl
Bước 3:
Ta có phương trình hoàn chỉnh:
CaCO3 + 2HCl --> CaCl2 + CO2 + H2O
Ví dụ 3: Cân bằng phương trình hóa học sau đây:
Fe(OH)3 + H2SO4 -- > Fe2(SO4)3 + H2O
Lời giải:
Bước 1:
Fe(OH)3 + H2SO4 ---> Fe2(SO4)3 + H2O (3)
Bước 2:
(3) VP có 3 nhóm SO4 => Thêm 3 vào phân tử H2SO4
(3) VP có 2 nguyên tử Fe => Thêm 2 vào phân tử Fe(OH)3
Bước 3:
Ta có phương trình hoàn chỉnh:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Ví dụ 4: Cân bằng phương trình hóa học sau đây:
P + O2 ---> P2O5
Lời giải:
Bước 1:
P + O2 ---> P2O5
Bước 2:
+ Ta xét VP có 5 nguyên tử O; VT có 2 nguyên tử O
Đối với phương trình như này, ta sẽ lấy bội chung nhỏ nhất
BCNN của 2 và 5 là 10
=> Thêm 5 vào phân tử O2; thêm 2 vào phân tử P2O5
Bước 3:
4P + 5O2 → 2P2O5
Ví dụ 5: Cân bằng phương trình hóa học sau:
KOH + Mg3(PO4)2 -- > K3PO4 + Mg(OH)2
Lời giải:
Bước 1:
KOH + Mg3(PO4)2 -- > K3PO4 + Mg(OH)2
Bước 2:
- VT có 2 nhóm PO4 => Thêm 3 vào K3PO4
- Thêm 6 vào KOH; và thêm 3 vào Mg(OH)2
Bước 3:
Ta có phương trình hoàn chỉnh:
6KOH + Mg3(PO4)2 → 2 K3PO4 + 3Mg(OH)2
Một số bài tập điển hình về mol có lời giải
Dạng 1: Tính số mol các chất, số nguyên tử và số phân tử
* Một số lưu ý cần nhớ:
- Số nguyên tử và số phân tử:
Số nguyên tử = n nguyên tử . 6 . 1023
Số phân tử = n phân tử . 6. 1023
* Một số ví dụ điển hình:
Ví dụ 1: a. Hãy tính số nguyên tử hidro có chứa trong 1 mol nước
b. Phải lấy bao nhiêu mol phân tử O2 để có 1,5 . 1023 phân tử CO2
Lời giải:
a, Ta có:
1 mol H2O có trong 6 . 1023 phân tử H2O
1 phân tử nước có 2 nguyên tử hidro
=> 1 mol nước chứa số nguyên tử hidro là:
6 . 1023 . 2 = 12 . 1023
b, 1 mol phân tử CO2 có chứa 6 . 1023 phân tử
=> x mol phân tử CO2 có chứa 1,5 . 1023 phân tử
x = (1,5 . 1023) : (6 . 1023) = 0,25 mol
Ví dụ 2: Hãy cho biết số nguyên tử hoặc phân tử có trong mỗi lượng chất sau đây:
a, 2 mol nguyên tử Fe
b, 0,5 mol phân tử Na2SO4
c, 1,5 mol phân tử Ba(NO3)2
Lời giải:
a, 2 . 6. 1023 = 12 . 1023 nguyên tử Fe
b, 0,5 . 6 . 1023 = 3 . 1023 phân tử Na2SO4
c, 1,5 . 6 . 1023 = 9 . 1023 mol phân tử Ba(NO3)2
Dạng 2: Tính thể tích của chất khí ở điều kiện tiêu chuẩn
* Một số lưu ý cần nhớ:
Thể tích mol chất khí là thể tích chiếm bằng N phân tử chất đó
Ở điều kiện tiêu chuẩn, thể tích của chất khí là 22,4 lít
Ví dụ 3: Em hãy cho biết khối lượng của N phân tử những chất sau:
a. HNO3 b. Mg(OH)2
Lời giải:
a, Khối lượng 1 phân tử HNO3 là
1 + 14 + 16 . 3 = 63 dvC
=> Khối lượng 1 mol phân tử HNO3 là : 63 gam
b, Khối lượng 1 phân tử Mg(OH)2 là:
24 + 17 . 2 = 58 dvC
=> Khối lượng 1 mol phân tử Mg(OH)2 là: 58 gam
* Một số ví dụ điển hình
Ví dụ 1 : Tính thể tích của một số chất khí sau (điều kiện tiêu chuẩn):
a, 1 mol khí H2
b, 2,5 mol khí CO2
c, 3 mol khí CH4
Lời giải:
a, 1 mol khí H2 có thể tích là 22,4 lít (đktc)
b, 1 mol khí CO2 có thể tích là 22,4 lít (đktc)
=> 2,5 mol khí CO2 có thể tích là x lít
=> x = 2,5 . 22,4 = 56 lít
c, 1 mol khí CH4 có thể tích là 22,4 lít
3 mol khí CH4 có thể tích là y lít
=> y = 3 . 22,4 = 67,2 lít
Ví dụ 2: Một hỗn hợp khí X gồm 0,25 mol khí O2; 0,2 mol khí SO2; 0,5 mol khí H2. Tính thể tích của hỗn hợp khí X ở đktc
Lời giải:
Tổng số mol khí có trong hỗn hợp X là:
0,25 + 0,2 + 0,5 = 0,95 mol
=> Thể tích của hỗn hợp khí trên là:
0,95 . 22,4 = 21,28 lít