Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 8 Bài 4: Nguyên tử chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Nguyên tử lớp 8.
Giải bài tập Hóa học lớp 8 Bài 4: Nguyên tử
Bài tập (trang 15, 16 SGK Hóa học 8)
“……….là hạt vô cùng nhỏ, trung hòa về điện : từ …………tạo ra mọi chất. Nguyên tử gồm …………mang điện tích dương và vỏ tạo bởi……………”
“Nguyên tử là hạt vô cùng nhỏ, trung hòa về điện : từ nguyên tử tạo ra mọi chất. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm”.
b) Hãy nói tên, kí hiệu và điện tích của những hạt mang điện.
c) Những nguyên tử cùng loại có cùng số hạt nào trong hạt nhân ?
a) Nguyên tử được tạo thành từ ba loại hạt dưới nguyên tử đó là: electron, proton và nơtron.
b)
- Electron: kí hiệu là e, mang điện tích âm (-1).
- Proton: kí hiệu là p, mang điện tích dương (+1).
- Notron: kí hiệu là n, không mang điện
Ta có bảng sau:
|
Tên |
Proton |
Electron |
|
Kí hiệu |
p |
e |
|
Điện tích |
+1 |
-1 |
c) Các nguyên tử cùng loại có cùng số hạt proton trong hạt nhân.
Trong nguyên tử, electron luôn chuyển động rất nhanh quanh hạt nhân và sắp xếp thành từng lớp, mỗi lớp có một số electron nhất định.
Thí dụ: Nguyên tử Oxi có 8 electron chia hai lớp, lớp trong có 2 electron và lớp ngoài có 6 electron.
Mô hình nguyên tử oxi:
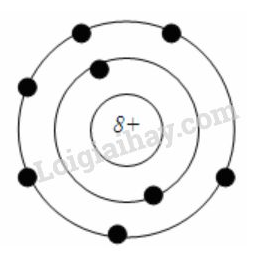
Hãy chỉ ra : số p trong hạt nhân, số e trong nguyên tử và số e lớp ngoài cùng của mỗi nguyên tử.
- Số p trong hạt nhân: mang điện tích dương
- Số e nguyên tử: Tất cả các chấm xanh chạy xung quanh hạt nhân
- Số e lớp ngoài cùng: Các chấm xanh ở vòng trong ngoài cùng của nguyên tử
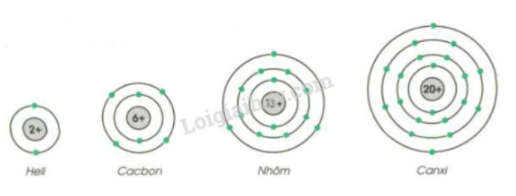
|
Nguyên tử |
Số p trong hạt nhân |
Số e trong nguyên tử |
Số lớp electron |
Số e lớp ngoài cùng |
|
Heli |
2 |
2 |
1 |
2 |
|
Cacbon |
6 |
6 |
2 |
4 |
|
Nhôm |
13 |
13 |
3 |
3 |
|
Canxi |
20 |
20 |
4 |
2 |
1. Định nghĩa
- Nguyên tử là hạt vô cùng nhỏ, trung hoà về điện, cấu tạo nên các chất.
- Đường kính nguyên tử khoảng 10-8 cm
Ví dụ về sự nhỏ bé của nguyên tử: 4 triệu nguyên tử sắt xếp liền nhau mới dài cỡ 1 mm!
2. Cấu tạo
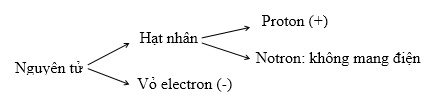
Chú ý: + Vì nguyên tử trung hòa về điện => số proton = số electron
+ khối lượng nguyên tử ≈ khối lượng hạt nhân
|
|
Hạt electron |
Hạt proton |
Hạt nơtron |
|
Kí hiệu |
e |
p |
n |
|
Điện tích |
- 1 |
+ 1 |
Không mang điện |
Chú ý: Hiđro là nguyên tử đặc biệt chỉ có duy nhất một hạt proton.
3. Lớp electron
- Trong nguyên tử, các e chuyển động rất nhanh và sắp xếp thành từng lớp từ trong ra ngoài, có một số electron nhất định.
+ Lớp 1: có tối đa 2e
+ Lớp 2, 3, 4… tối đa 8e
- Khối lượng nguyên tử = số P + số N + số e = số P + số N (vì e có khối lượng rất nhỏ nên bỏ qua).
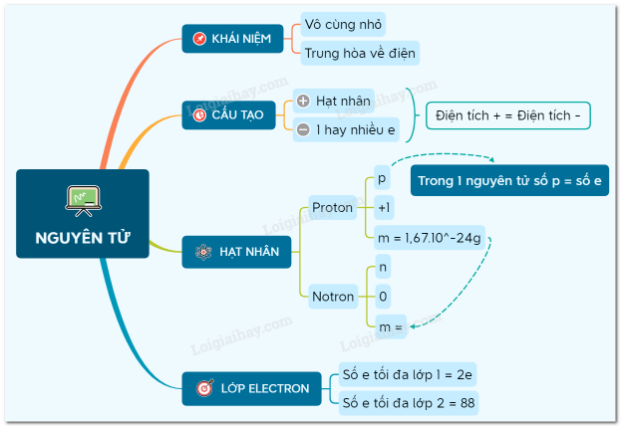
Sơ đồ tư duy: Nguyên tử
Dạng 1: Lý thuyết về cấu tạo nguyên tử
* Một số lưu ý cần nhớ
|
1. Nguyên tử : Là hạt vô cùng nhỏ, trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi các electron mang điện tích âm. 2. Hạt nhân nguyên tử : Được tạo ra bởi các proton và nơtron. Trong mỗi nguyên tử, số proton (p, +) bằng số electron (e, -). Tức là
- Hạt proton và notron có khối lượng tương đương nhau, còn hạt electron có khối lượng rất bé, không đáng kể. => Vì vậy, khối lượng hạt nhân được coi là khối lượng nguyên tử 3. Lớp electron : Electron luôn chuyển động quanh hạt nhân và sắp xếp thành từng lớp. Các nguyên tử có thể liên kết với nhau nhờ electron. |
* Một số ví dụ điển hình
Ví dụ 1: Trong nguyên tử, hạt mang điện là
A. proton
B. proton và hạt nhân
C. proton và electron
D. proton và notron
Hướng dẫn giải chi tiết
Trong nguyên tử, hạt mang điện là hạt proton (+) và electron (-)
Đáp án C
Ví dụ 2: Nguyên tử trung hòa về điện vì
A. số proton bằng số electron
B. số proton bằng số electron
C. số notron bằng số electron
D. có cùng số proton
Hướng dẫn giải chi tiết
Nguyên tử trung hòa về điện vì có số proton bằng số electron.
Đáp án A
Ví dụ 3: Để biểu thị khối lượng của một nguyên tử, người ta dùng đơn vị
A. gam
B. miligam
C. kilogam
D. đvC
Hướng dẫn giải chi tiết
Để biểu thị khối lượng của một nguyên tử, người ta dùng đơn vị đvC
Đáp án D
Ví dụ 4: Trong khoảng không gian giữa hạt nhân và lớp vỏ electron của nguyên tử có những gì?
A. Electron
B. Notron
C. Proton
D. Không có gì
Hướng dẫn giải chi tiết:
Nguyên tử có cấu tạo rỗng => có khoảng không gian trống giữa hạt nhân và lớp vỏ electron của nguyên tử
Đáp án D.
Dạng 2: Tính khối lượng của nguyên tử
* Một số lưu ý cần nhớ
|
- Ta có khối lượng của 1 hạt proton là 1,6726 . 10-24 gam. Khối lượng của 1 hạt notron là 1,675 . 10-24 gam, khối lượng của 1 hạt electron là 9,1 . 10 -28 gam. Gọi mp, mn, me lần lượt là khối lượng của proton, notron, electron => m nguyên tử = mp + mn + me Vì khối lượng electron rất nhỏ, nên ta coi khối lượn nguyên tử bằng khối lượng của hạt nhân. |
* Một số ví dụ điển hình
Ví dụ 1: Một nguyên tử nhôm (Al) có 13 proton, 13 electron và 14 notron. Hãy xác định khối lượng của một nguyên tử nhôm.
Hướng dẫn giải chi tiết
Ta có mp = 13 . 1,6726 . 10-24 = 2,174.10-23 = 21,74.10-24 gam
mn = 14 . 1,675 . 10-24 = 2,345.10-23 = 23,45.10-24 gam
me = 13 . 9,1 . 10-28 = 1,183 . 10-26 = 0,01183 . 10-24 gam
=> Khối lượng 1 nguyên tử nhôm là:
mp + mn + me = 21,74.10-24 + 23,45.10-24 + 0,01183 . 10-24 = 45,201 . 10-24 gam
Ví dụ 2: Hạt nhân nguyên tử oxi có chứa 8 notron và 8 proton. Hãy tính khối lượng nguyên tử oxi theo đơn vị gam.
Hướng dẫn giải chi tiết
Ta có: đối với 1 nguyên tử, khối lượng của hạt nhân xấp xỉ bằng khối lượng của nguyên tử
=> m nguyên tử O = mp + mn = 8 . 1,672 . 10-24 + 8 . 1,675 . 10-24 = 2,6776 . 10-23= 26,776 . 10-24 gam
Dạng 3: Xác định số proton, notron và số electron của nguyên tử
* Một số lưu ý cần nhớ
|
- Trong một nguyên tử có số p = số e (1) Gọi số p, số e, số n có trong nguyên tử lần lượt là p, e, n => Tổng số hạt có trong X là: p + e + n (2) Từ (1) và (2) => Tổng số hạt có trong X là 2p + n Kết hợp với các dữ kiện trong đề bài để giải hệ phương trình => số p, n , e |
* Một số ví dụ điển hình:
Ví dụ 1: Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tử X có số proton là:
Hướng dẫn giải chi tiết:
Nguyên tử của nguyên tố X có tổng số hạt là 40.
Tổng số hạt = p + e + n = 2p + n = 40 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 12
=> p + e – n = 2p – n = 12 (2)
Từ (1) và (2) => p = 13; n = 14
Số proton có trong nguyên tử X bằng 13
Ví dụ 2: Tổng số hạt của nguyên tử nguyên tố T là 60. Số hạt mang điện gấp đôi số hạt không mang điện. Số hạt nơtron trong nguyên tử nguyên tố T là:
Hướng dẫn giải chi tiết:
Vì tổng số hạt của nguyên tử nguyên tố T là 60 nên
p + e + n = 60 → 2p + n = 60 (1)
Vì số hạt mang điện gấp đôi số hạt không mang điện nên
p + e = 2n → 2p = 2n → p – n = 0 (2)
Giải hệ (1) và (2) ta có: p = 20 và n = 20
Vậy số hạt nơtron trong nguyên tử nguyên tố T là 20.
Ví dụ 3: Nguyên tử nguyên tố Y có tổng số hạt cơ bản là 40 hạt. Trong hạt nhân của Y, số hạt mang điện ít hơn số hạt không mang điện là 1 hạt. Y có số proton là:
Hướng dẫn giải chi tiết:
Nguyên tử nguyên tố Y có tổng số hạt cơ bản là 40 hạt
=> p + n + e = 2p + n = 40 (1)
Trong hạt nhân Y có số hạt mang điện ít hơn số hạt không mang điện là 1 hạt
=> n – p = 1 (2)
Từ (1) và (2) => p = 13, n = 14
Số proton có trong Y bằng 13.
Dạng 4: Xác định, viết sơ đồ cấu tạo của một nguyên tử
* Một số lưu ý cần nhớ:
|
- Để viết sơ đồ electron nguyên tử, ta dùng đường tròn để biểu diễn. Mỗi vòng tròn là một lớp electron. Người ta qui ước số electron có trong một lớp - Lớp thứ nhất chứa tối đa 2 electron - Lớp thứ hai chứa tối đa 8 electron… Mỗi electron được biểu thị bằng một dấu tròn đậm. |
* Một số ví dụ điển hình
Ví dụ 1: Nguyên tử Z có 16 proton trong hạt nhân. Hãy vẽ cấu tạo của nguyên tử Z.
Hướng dẫn giải chi tiết
Trong hạt nhân có số p = số e = 16
=> Lớp 1 có 2 electron, lớp 2 có 8 electron, lớp 3 có 6 electron.
Ta có sơ đồ:
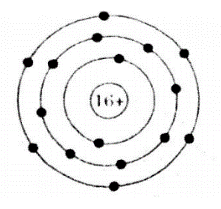
Ví dụ 2: Cho sơ đồ hình vẽ như sau:
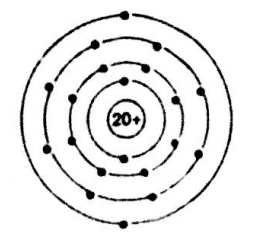
a, Hãy chỉ ra số proton, số electron trong nguyên tử.
b, Số lớp electron, số e lớp ngoài cùng có trong nguyên tử
Hướng dẫn giải chi tiết:
a, Trong nguyên tử, số proton = số electron = 20
b, chất này có số lớp e là 4, và có 2 electron lớp ngoài cùng.