Tailieumoi.vn xin giới thiệu bài viết Công thức electron của SO3 (Sulfur trioxide) theo chương trình mới, và một số bài tập kèm theo giúp bạn nắm vững kiến thức, học tốt môn Hóa hơn.
Công thức electron của SO3 theo chương trình mới, đầy đủ nhất
1. Công thức electron của SO3
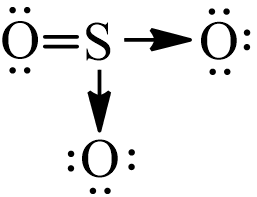
- Sự tạo thành phân tử SO3:
+ Nguyên tử sulfur (S) có cấu hình electron là 1s22s22p63s23p4 ⇒ S có 6 electron ở lớp ngoài cùng ⇒ Cần nhận thêm 2 electron để đạt được cấu hình electron bền vững giống khí hiếm.
+ Cấu hình electron của O là: 1s22s22p4 ⇒ O có 6 electron ở lớp ngoài cùng ⇒ Cần nhận thêm 2 electron để đạt được cấu hình electron bền vững của khí hiếm.
+ Nguyên tử S và một nguyên tử O sẽ góp chung 2 electron để tạo thành 2 cặp electron dùng chung. Khi đó nguyên tử S và một nguyên tử O đó đã đạt octet.
+ Còn hai nguyên tử O chưa đạt octet, S sẽ sử dụng một cặp electron chưa liên kết làm cặp electron chung với mỗi nguyên tử O còn lại. Nguyên tử S đóng góp cặp electron nên S là nguyên tử cho, còn nguyên tử O không đóng góp electron nên đóng vai trò nhận.
- Vậy công thức electron của SO3 là:
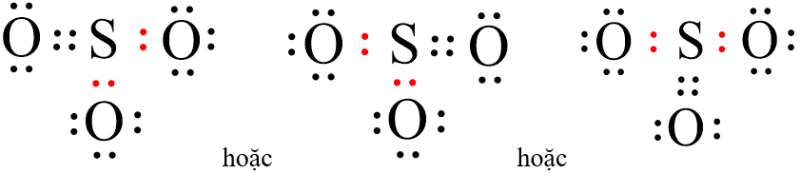
- Nhận xét:
+ Phân tử SO3 có 4 cặp electron chung, trong đó 2 cặp electron do một nguyên tử O và nguyên tử S góp chung, 2 cặp electron chỉ do nguyên tử S đóng góp.
+ Trong phân tử SO3 có 8 cặp electron tự do của các nguyên tử O, nguyên tử S không còn electron tự do.
2. Công thức Lewis của SO3
a) Cách 1: Viết công thức Lewis dựa vào công thức electron
Từ công thức electron, thay 1 cặp electron dùng chung bằng 1 gạch nối “–” giữa hai nguyên tử ta được công thức Lewis
Từ công thức electron của SO3 ta thay mỗi cặp electron bằng một gạch nối. Ta được công thức Lewis của SO3 là:
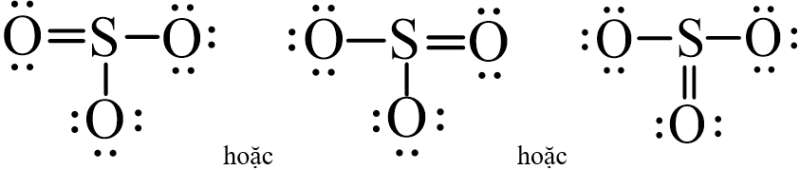
- Để biểu diễn liên kết cho – nhận: Cặp electron chỉ do nguyên tử S đóng góp ta thay bằng mũi tên từ nguyên tử cho (nguyên tử S) đến nguyên tử nhận (nguyên tử O).
Công thức Lewis của SO3 có thể được viết như sau:
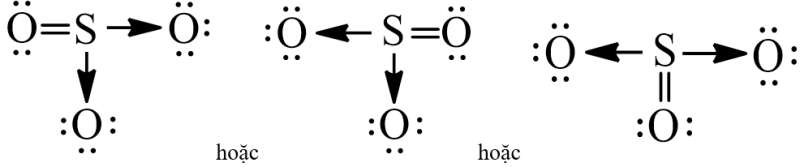
b) Cách 2: Viết công thức Lewis dựa vào quy tắc
Bước 1: Tính tổng số electron hóa trị trong phân tử
S có 6 electron hóa trị, O có 6 electron hóa trị. Trong phân tử SO3 có 1 nguyên tử S và 3 nguyên tử O.
Vậy tổng số electron hóa trị = 6 + 6.3 = 24 electron.
Bước 2. Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử
Trong phân tử SO3, S có độ âm điện nhỏ hơn. Vì vậy S là nguyên tử trung tâm, còn các nguyên tử O được xếp xung quanh:
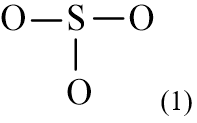
Bước 3. Tính số electron hóa trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết.
Số electron hóa trị chưa tham gia liên kết trong sơ đồ là:
24 – 2.3 = 18 electron.
Hoàn thiện octet cho các nguyên tử có độ âm điện lớn hơn trong sơ đồ.
Trong công thức (1), xung quanh mỗi nguyên tử O mới có 2 electron nên cần phải bổ sung 6 electron vào mỗi nguyên tử này. Ta được công thức (2):
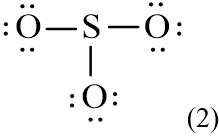
Số electron hóa trị còn lại: 18 – 6.3 = 0
Nguyên tử trung tâm S có 6 electron hóa trị, chưa đạt octet.
Bước 4. Chuyển cặp electron chưa liên kết trên nguyên tử xung quanh thành electron liên kết sao cho nguyên tử trung tâm thỏa mãn quy tắc octet.
Vì S chưa đạt octet, cần chuyển một cặp electron từ 1 nguyên tử O thành cặp electron dùng chung giữa S và O.
Công thức Lewis của SO3 thu được là:

Nhận xét:
+ 1,7 > ∆χ(S – O) = |2,58 – 3,44| = 0,86 > 0,4 ⇒ liên kết S – O trong phân tử SO3 thuộc loại liên kết cộng hóa trị phân cực. Liên kết phân cực về phía nguyên tử O.
+ Phân tử SO3 có cấu trúc tam giác phẳng.
3. Công thức cấu tạo của SO3
Từ công thức Lewis, ta loại bỏ đi các electron tự do (electron không tham gia liên kết) thu được công thức cấu tạo.
- Công thức cấu tạo của SO3 là:
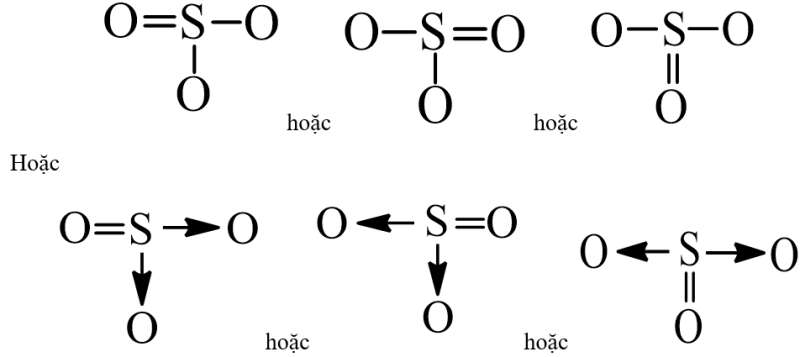
- Nhận xét: Trong phân tử SO3 có một liên kết đôi S = O và hai liên kết đơn S – O
4. Bài tập mở rộng về SO3
Câu 1. Công thức biểu diễn cấu trúc Lewis của phân tử SO3 là
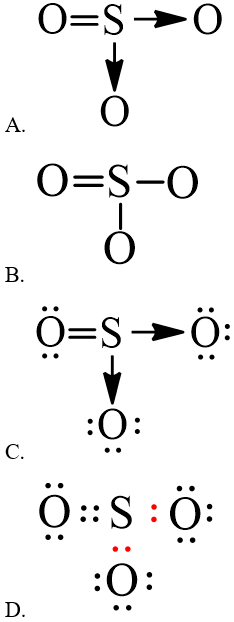
Hướng dẫn giải
Đáp án đúng là: C
Công thức Lewis của SO3 là:
Đáp án A, B biểu diễn công thức cấu tạo của SO3
Đáp án D biểu diễn công thức electron của SO3.
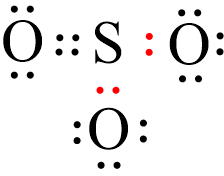
Câu 2. Xét phân tử SO3, số cặp electron chỉ do nguyên tử S bỏ ra góp chung với các nguyên tử O thể hiện liên kết cho – nhận là
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải
Đáp án đúng là: B
Khi tạo thành phân tử SO3:
+ S và O cùng có 6 electron hóa trị và đều cần thêm 2 electron để đạt octet.
+ Nguyên tử S và một nguyên tử O sẽ góp chung 2 electron để tạo thành 2 cặp electron dùng chung. Khi đó nguyên tử S và một nguyên tử O đó đã đạt octet.
+ Còn hai nguyên tử O chưa đạt octet, S sẽ sử dụng một cặp electron chưa liên kết làm cặp electron chung với mỗi nguyên tử O còn lại. Nguyên tử S đóng góp cặp electron nên S là nguyên tử cho, còn nguyên tử O không đóng góp electron nên đóng vai trò nhận.
Vậy số cặp electron chỉ do nguyên tử S bỏ ra góp chung với các nguyên tử O thể hiện liên kết cho – nhận là 2.
Xem thêm công thức electron của một số chất thường gặp hay, chi tiết khác:
Công thức electron của HNO3 (chương trình mới)
Công thức electron của C2H2 (chương trình mới)
Công thức electron của C2H4 (chương trình mới)
Công thức electron của CS2 (chương trình mới)
Công thức electron của HOCl (chương trình mới)