Lời giải bài tập Khoa học tự nhiên lớp 7 Bài 6: Giới thiệu về liên kết hóa học sách Chân trời sáng tạo hay, ngắn gọn sẽ giúp học sinh dễ dàng trả lời câu hỏi KHTN 7 Bài 6 từ đó học tốt môn Khoa học tự nhiên 7.
Giải bài tập KHTN lớp 7 Bài 6: Giới thiệu về liên kết hóa học
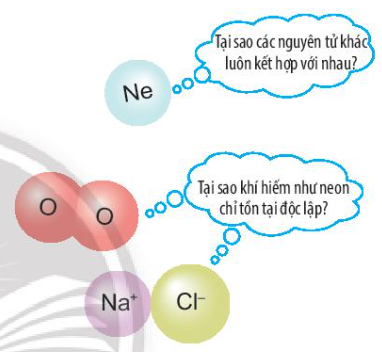
Các nguyên tử của nguyên tố kết hợp với nhau theo quy tắc nào?
Trả lời:
Nguyên tử của các nguyên tố khác có xu hướng tham gia liên kết hóa học để đạt được lớp electron ngoài cùng giống khí hiếm bằng cách nhường, nhận hay dùng chung các electron
=> Các nguyên tử của nguyên tố kết hợp với nhau theo quy tắc nhường, nhận hoặc dùng chung electron
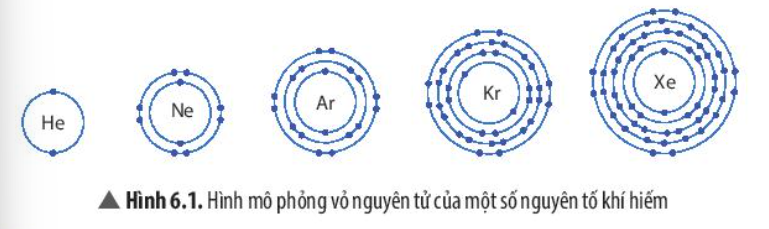
1. Vỏ nguyên tử khí hiếm
Phương pháp giải:
- So sánh số electron lớp ngoài cùng và số lớp electron của các nguyên tử
Trả lời:
- Giống nhau: Đều có 8 electron ở lớp ngoài cùng
- Khác nhau:
+ Nguyên tử Ne có 2 lớp electron
+ Nguyên tử Ar có 3 lớp electron
+ Nguyên tử Kr có 4 lớp electron
+ Nguyên tử Xe có 5 lớp electron
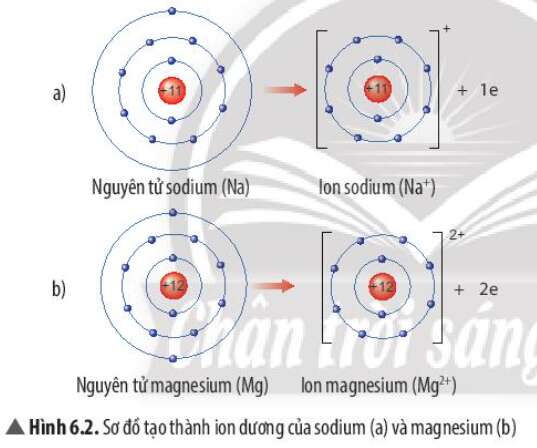
2. Liên kết Ion
Phương pháp giải:
- Nguyên tử Na cho đi 1 electron ở lớp ngoài cùng
- Nguyên tử Mg cho đi 2 electron ở lớp ngoài cùng
Trả lời:
- Sự tạo thành ion sodium: Nguyên tử sodium (Na) cho đi 1 electron lớp ngoài cùng để tạo thành ion dương Na+
- Sự tạo thành ion magnesium: Nguyên tử magnesium (Mg) cho đi 2 electron lớp ngoài cùng để tạo thành ion dương Mg2+
=> Sau khi nhường electron, ion sodium và ion magnesium đều có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)
Phương pháp giải:
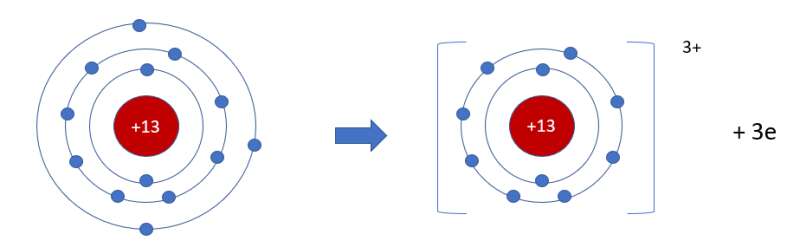
- Aluminium là nguyên tố kim loại => Có xu hướng nhường electron
- Aluminium có 3 electron ở lớp ngoài cùng => Nhường đi 3 electron
Trả lời:
- Trong bảng tuần hoàn, aluminium thuộc ô màu xanh nằm ở
+ Nhóm IIIA => Có 3 electron ở lớp ngoài cùng
+ Chu kì 3 => Có 3 lớp electron
- Nguyên tố aluminium là nguyên tố kim loại có 3 electron ở lớp ngoài cùng
=> Có xu hướng nhường đi 3 electron tạo thành ion dương aluminum (Al3+)
- Sơ đồ tạo thành ion aluminium:
Phương pháp giải:
- Nguyên tử Cl nhận thêm 1 electron ở lớp ngoài cùng
- Nguyên tử Mg nhận thêm 2 electron ở lớp ngoài cùng
Trả lời:
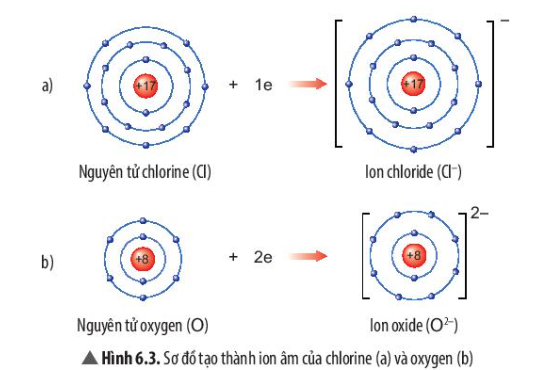
- Sự tạo thành ion chloride: Nguyên tử chlorine (Cl) nhận thêm 1 electron ở lớp ngoài cùng để tạo thành ion âm Cl-
- Sự tạo thành ion oxide: Nguyên tử oxygen (O) nhận thêm 2 electron ở lớp ngoài cùng để tạo thành ion âm O2-
- Sau khi nhận electron, ion chloride có 3 lớp electron và có 8 electron ở lớp ngoài cùng
=> Giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)
- Sau khi nhận electron, ion oxide có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Giống sự phân bố electron của nguyên tử Argon (Ar)
Phương pháp giải:
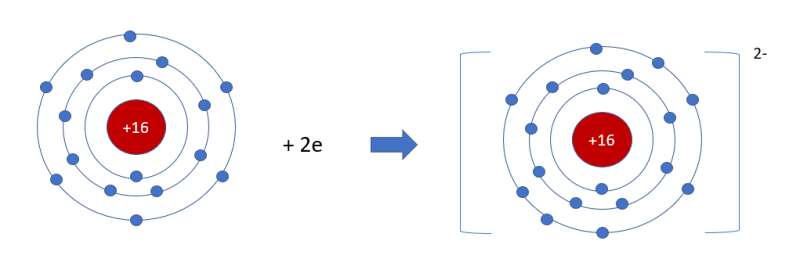
- Sulfur là nguyên tố phi kim => Có xu hướng nhận electron
- Aluminium có 6 electron ở lớp ngoài cùng => Nhận thêm 2 electron
Trả lời:
- Trong bảng tuần hoàn, sulfur thuộc ô màu hồng nằm ở
+ Nhóm VIA => Có 6 electron ở lớp ngoài cùng
+ Chu kì 3 => Có 3 lớp electron
- Nguyên tố sulfur là nguyên tố phi kim có 6 electron ở lớp ngoài cùng
=> Có xu hướng nhận thêm 2 electron tạo thành ion âm sulfide (S2-)
- Sơ đồ tạo thành ion sulfide:
Phương pháp giải:
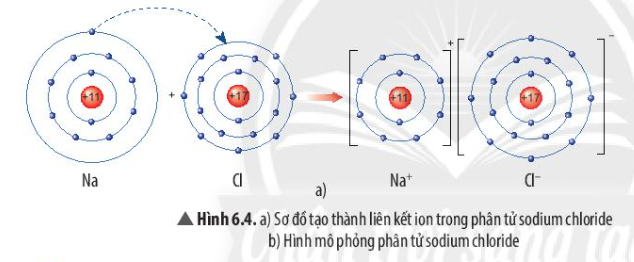
- Nguyên tử Na nhường 1 electron cho nguyên tử Cl
- Nguyên tử Cl nhận thêm 1 electron từ nguyên tử Na
Trả lời:
- Nguyên tử Na nhường 1 electron cho nguyên tử Cl, tạo thành ion dương
- Nguyên tử Cl nhận 1 electron từ nguyên tử Na, tạo thành ion âm
=> Ion dương và ion âm mang điện tích trái dấu nên hút nhau, tạo thành liên kết ion
- Ứng dụng của sodium chloride
+ Sát trùng vết thương, cung cấp muối khoáng cho cơ thể bị thiếu nước
+ Dùng làm gia vị, bảo quản thực phẩm, khử mùi, kiểm soát quá trình lên men
+ Trị cảm lạnh, tiêu độc, làm trắng, chữa viêm, hôi miệng
+ Dùng chăm sóc sức khỏe gia súc, gia cầm, làm thành phần phân bón cho cây trồng
Phương pháp giải:
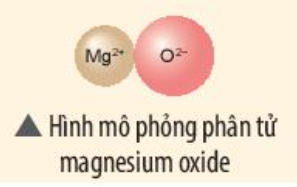
Magnesium oxide được tạo thành từ ion Mg2+ và ion O2-
=> Nguyên tử Mg đã nhường 2 electron cho nguyên tử O
Trả lời:
- Nguyên tử Mg (có số hiệu nguyên tử = 12) nhường 2 electron cho O, tạo thành ion Mg2+
- Nguyên tử O (có số hiệu nguyên tử = 8) nhận 2 electron từ Mg, tạo thành ion O2-
=> Ion dương Mg2+ và ion âm O2- mang điện tích trái dấu nên hút nhau, tạo thành liên kết ion
- Sơ đồ mô tả quá trình tạo thành liên kết ion trong phân tử hợp chất magnesium oxide:
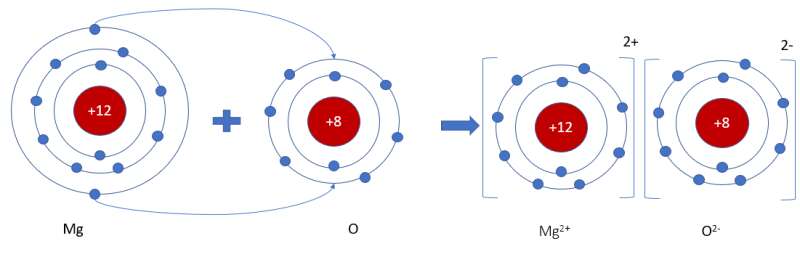

Phương pháp giải:
- Calcium chloride gồm 1 nguyên tử Ca và 2 nguyên tử Cl
- Mỗi nguyên tử Cl nhận 1 electron của nguyên tử Ca => Tạo thành ion Ca2+ và ion Cl-
Trả lời:
- Ứng dụng của calcium chloride:
+ Tác nhân sấy khô hoặc chất hút ẩm
+ Hợp chất làm tan băng
+ Chất điện giải, sản xuất các loại đồ uống
+ Chất phụ gia trong quá trình hóa dẻo, dùng làm chất tải lạnh cho kem
+ Ứng dụng trong hệ thống tiêu nước và xử lý nước thải công nghiệp
- Sơ đồ tạo thành liên kết trong phân tử calcium chloride:
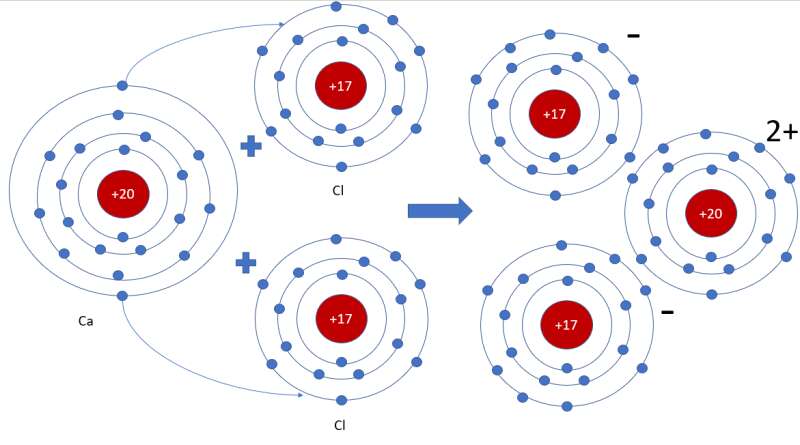
3. Liên kết cộng hóa trị
Phương pháp giải:
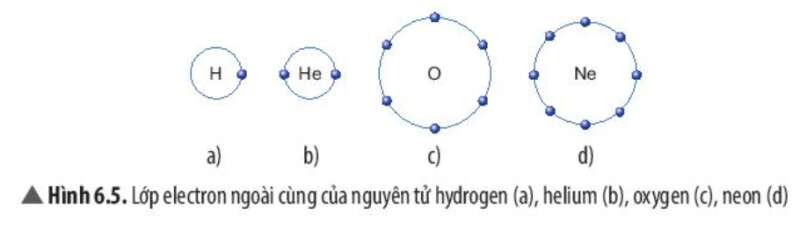
- Hydrogen gần với nguyên tố khí hiếm Helium
- Oxygen gần với nguyên tố khí hiếm Neon
Trả lời:
- Hydrogen gần với nguyên tố khí hiếm Helium
- H có 1 electron lớp ngoài cùng, He có 2 electron lớp ngoài cùng
=> Nguyên tử hydrogen có xu hướng nhận thêm 1 electron để đạt cấu hình của Helium
- Oxygen gần với nguyên tố khí hiếm Neon
- H có 6 electron lớp ngoài cùng, Ne có 8 electron lớp ngoài cùng
=> Nguyên tử Oxygen có xu hướng nhận thêm 2 electron để đạt cấu hình của Neon
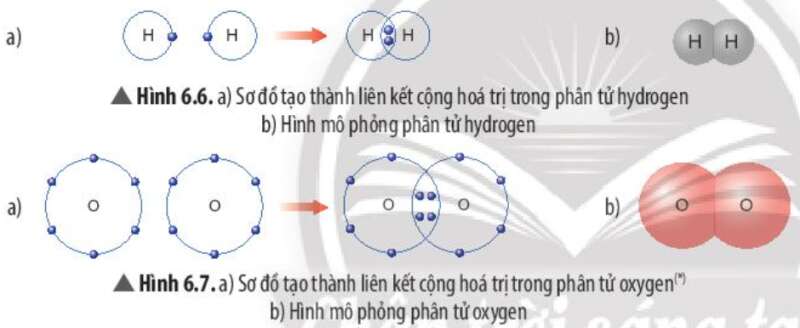
Phương pháp giải:
Số electron ngoài cùng của mỗi nguyên tử = tổng số electron dùng chung giữa các nguyên tử + số electron còn lại của mỗi nguyên tử
Trả lời:
- Xét phân tử hydrogen: mỗi nguyên tử hydrogen có 2 electron lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Helium
- Xét phân tử Oxygen: mỗi nguyên tử Oxygen có 8 electron ở lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Neon
Phương pháp giải:
- Nguyên tử H có 1 electron ở lớp ngoài cùng, cần thêm 1 electron để đạt cấu hình electron của He
=> Góp 1 electron tạo 1 cặp electron dùng chung
- Nguyên tử O có 6 electron ở lớp ngoài cùng, cần thêm 2 electron để đạt cấu hình electron của Ne
=> Góp chung 2 electron tạo 2 cặp electron dùng chung
Trả lời:
- Xét phân tử hydrogen (gồm 2 nguyên tử H): Mỗi nguyên tử H bỏ ra 1 electron để tạo thành 1 cặp electron dùng chung => Hình thành liên kết cộng hóa trị
- Xét phân tử oxygen (gồm 2 nguyên tử O): Mỗi nguyên tử O bỏ ra 2 electron để tạo thành 2 cặp electron dùng chung => Hình thành liên kết cộng hóa trị
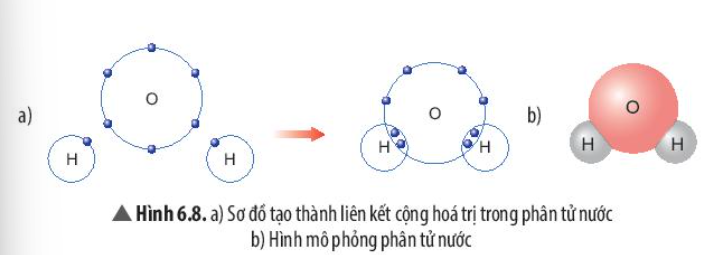
Phương pháp giải:
Sau khi hình thành liên kết, số electron ngoài cùng của mỗi nguyên tử = tổng số electron dùng chung giữa các nguyên tử + số electron còn lại của mỗi nguyên tử
Trả lời:
- Số electron dùng chung của nguyên tử H và O là 4
- Trong phân tử nước:
+ Nguyên tử O có 8 electron lớp ngoài cùng => Giống khí hiếm Ne
+ Nguyên tử H có 2 electron lớp ngoài cùng => Giống khí hiếm He
Phương pháp giải:
Mỗi nguyên tử H bỏ ra 1 electron để góp chung với nguyên tử O
Trả lời:
Khi O kết hợp với H, nguyên tử O góp 2 electron, mỗi nguyên tử H góp 1 electron.
=> Giữa nguyên tử O và nguyên tử H có 1 đôi electron dùng chung
- Hạt nhân nguyên tử O và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử nước
Luyện tập trang 41 KHTN lớp 7: Vẽ sơ đồ hình thành liên kết cộng hóa trị trong các phân tử sau:
Phương pháp giải:
- Nguyên tử Cl có 7 electron lớp ngoài cùng => Cần nhận thêm 1 electron
=> Bỏ ra 1 electron để góp chung
- Nguyên tử H và nguyên tử N đều là phi kim
+ Nguyên tử H có 1 electron ở lớp ngoài cùng => Cần nhận thêm 1 electron
+ Nguyên tử N có 5 electron ở lớp ngoài cùng => Cần nhận thêm 3 electron
Trả lời:
- Xét phân tử khí chlorine
=> Mỗi nguyên tử Cl có 7 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiếm Ar, khi hình thành phân tử chlorine, hai nguyên tử Cl đã liên kết với nhau bằng cách mỗi nguyên tử Cl góp chung 1 electron tạo thành 1 cặp electron dùng chung
- Xét phân tử khí amonia
- Nguyên tử H có 1 electron ở lớp ngoài cùng
- Nguyên tử N có 5 electron ở lớp ngoài cùng
=> Nguyên tử H cần thêm 1 electron và N cần thêm 3 electron để đạt cấu hình electron bền vững của khí hiếm
=> Khi 3 nguyên tử H và 1 nguyên tử N liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử N góp ra 3 electron để tạo ra 3 đôi electron dùng chung
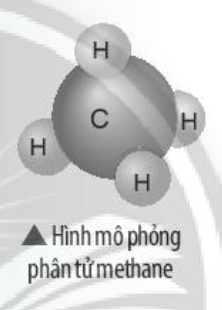
Phương pháp giải:
- Nguyên tử H và nguyên tử C đều là phi kim
+ Nguyên tử H có 1 electron ở lớp ngoài cùng => Cần nhận thêm 1 electron
+ Nguyên tử N có 4 electron ở lớp ngoài cùng => Cần nhận thêm 4 electron
Trả lời:
- Nguyên tử H có 1 electron ở lớp ngoài cùng
- Nguyên tử C có 4 electron ở lớp ngoài cùng
=> Nguyên tử H cần thêm 1 electron và N cần thêm 4 electron để đạt cấu hình electron bền vững của khí hiếm
=> Khi 4 nguyên tử H và 1 nguyên tử C liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử C góp ra 4 electron để tạo ra 4 đôi electron dùng chung
- Sơ đồ:
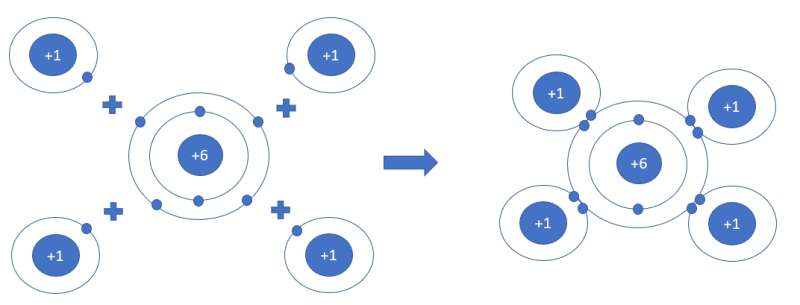
- Ứng dụng của methane:
+ Metan cháy tỏa nhiều nhiệt nên được dùng làm nhiên liệu
+ Là nguyên liệu để điều chiế hydrogen
+ Điều chế bột than và nhiều chất khác
4. Chất Ion, chất cộng hóa trị

Phương pháp giải:
- Dựa vào nguyên tử => ion tương ứng
- Quan sát Hình 6.9 => Thể của các chất ở điều kiện thường
Trả lời:
a) Phân tử Sodium chloride gồm 2 nguyên tố là Na và Cl
+ Nguyên tố Na có 1 electron ở lớp ngoài cùng => Có xu hướng nhường 1 electron => Ion tương ứng là Na+
+ Nguyên tố Cl có 7 electron ở lớp ngoài cùng => Có xu hướng nhận 1 electron => Ion tương ứng là Cl-
b) Phân tử Calcium chloride gồm 2 nguyên tố là Ca và Cl
+ Nguyên tố Ca có 2 electron ở lớp ngoài cùng => Có xu hướng nhường 2 electron => Ion tương ứng là Ca2+
+ Nguyên tố Cl có 7 electron ở lớp ngoài cùng => Có xu hướng nhận 1 electron => Ion tương ứng là Cl-
c) Phân tử Magnesium oxide gồm 2 nguyên tố là Mg và O
+ Nguyên tố Mg có 2 electron ở lớp ngoài cùng => Có xu hướng nhường 2 electron => Ion tương ứng là Mg2+
+ Nguyên tố O có 6 electron ở lớp ngoài cùng => Có xu hướng nhận 2 electron => Ion tương ứng là O2-
- Ở điều kiện thường, các chất đều ở thể rắn
Câu hỏi thảo luận 11 trang 42 KHTN lớp 7: Quan sát và cho biết thể của các chất có trong Hình 6.10

Phương pháp giải:
Quan sát Hình 6.10 và nhận xét thể của các chất
Trả lời:
Quan sát Hình 6.10:
+ Đường tinh luyện: thể rắn
+ Ethanol: thể lỏng
+ Carbon dioxide: thể khí
Phương pháp giải:
Một số chất cộng hóa trị là: khí oxygen, nước, khí amonia, hydrogen chloride, methane, nitrogen oxide
Trả lời:
Một số chất cộng hóa trị và thể của chúng ở điều kiện thường là:
+ Khí oxygen: thể khí
+ Nước: thể lỏng
+ Amonia: thể khí
+ Hydrogen chloride: thể lỏng
+ Methane: thể khí
+ Nitrogen oxide: thể khí
+ Gỗ (cenlulose): thể rắn
a) Hãy cho biết chất nào là hợp chất ion, chất nào là hợp chất cộng hóa trị
b) Nguyên tử của nguyên tố nào trong các chất trên có số electron ở lớp ngoài cùng nhiều nhất
Phương pháp giải:
- Chất ion là chất được tạo bởi các ion dương và ion âm (giữa kim loại và phi kim)
- Chất cộng hóa trị là chất được tạo thành nhờ liên kết cộng hóa trị (giữa các phi kim)
- Nguyên tử ở nhóm cao nhất thì có số electron lớp ngoài cùng nhiều nhất
Trả lời:
a)
- Hơi nước: gồm 2 nguyên tố là H (phi kim) và O (phi kim) => Chất cộng hóa trị
- Sodium chloride: gồm 2 nguyên tố là Na (kim loại) và Cl (phi kim) => Chất ion
- Potassium chloride: gồm 2 nguyên tố là K (kim loại) và Cl (phi kim) => Chất ion
- Carbon dioxide: gồm 2 nguyên tố là C (phi kim) và O (phi kim) => Chất cộng hóa trị
- Sulfur dioxide: gồm 2 nguyên tố là S (phi kim) và O (phi kim) => Chất cộng hóa trị
b) Các nguyên tố xuất hiện trong các chất trên là: H, O, Na, Cl, K, C, S
+ Nguyên tử H ở nhóm IA => Có 1 electron ở lớp ngoài cùng
+ Nguyên tử O ở nhóm VIA => Có 6 electron ở lớp ngoài cùng
+ Nguyên tử Na ở nhóm IA => Có 1 electron ở lớp ngoài cùng
+ Nguyên tử Cl ở nhóm VIIA => Có 7 electron ở lớp ngoài cùng
+ Nguyên tử K ở nhóm IA => Có 1 electron ở lớp ngoài cùng
+ Nguyên tử C ở nhóm IVA => Có 4 electron ở lớp ngoài cùng
+ Nguyên tử S ở nhóm VIA => Có 6 electron ở lớp ngoài cùng
=> Nguyên tử của nguyên tố Chlorine có số electron ở lớp ngoài cùng nhiều nhất
5. Một số tính chất của chất Ion và chất cộng hóa trị
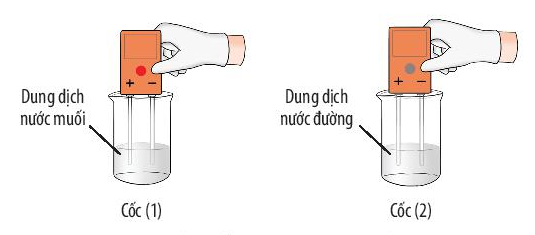
| Tính chất | Muối | Đường |
| Tan trong nước | ? | ? |
| Dẫn điện được | ? | ? |

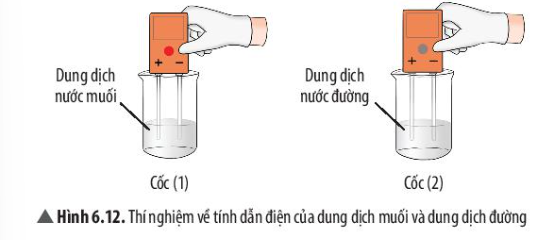
Phương pháp giải:
- Quan sát độ tan và độ dẫn điện của đường và muối ăn
Trả lời:
| Tính chất | Muối | Đường |
| Tan trong nước | V | V |
| Dẫn điện được | V | X |
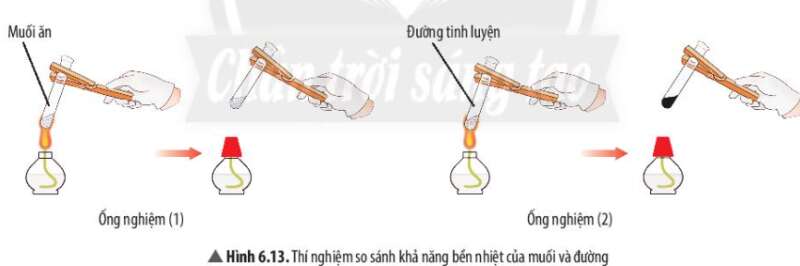
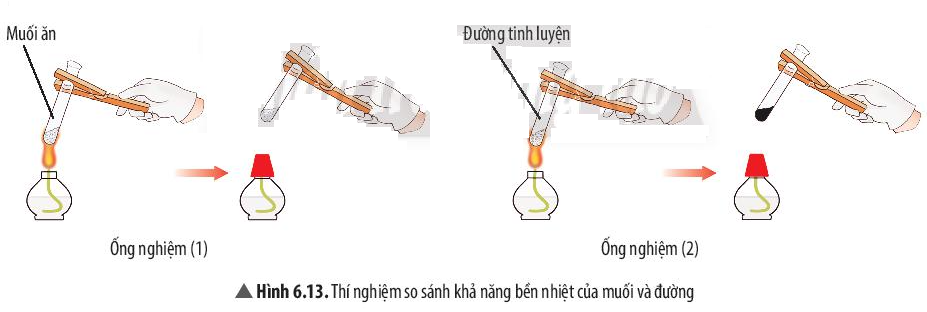
Phương pháp giải:
Ống nghiệm nào có sự tạo thành chất mới => Chất đó kém bền nhiệt hơn
Trả lời:
- Muối không có sự thay đổi sau khi đun nóng
- Đường (màu trắng) chuyển thành chất khác có màu đen
=> Ống nghiệm 2 (đường) có sự tạo thành chất mới
=> Muối bền nhiệt hơn
| Tính chất | Chất A | Chất B |
| Thể (25oC) | Rắn | Lỏng |
| Nhiệt độ sôi (oC) | 1500 | 64,7 |
| Nhiệt độ nóng chảy (oC) | 770 | -97,6 |
| Khả năng dẫn điện của dung dịch | Có | Không |
Phương pháp giải:
- Chất cộng hóa trị: tồn tại ở cả 3 thể trong điều kiện thường, có nhiệt độ sôi và nhiệt độ nóng chảy thấp, không dẫn điện
- Chất ion: chỉ tồn tại ở thể rắn trong điều kiện thường, có nhiệt độ sôi và nhiệt độ nóng chảy cao, dẫn điện tốt
Trả lời:
- Chất A: tồn tại ở thể rắn, nhiệt độ sôi và nhiệt độ nóng chảy cao, dẫn điện tốt => Chất ion
- Chất B: tồn tại ở thể lỏng, nhiệt độ sôi và nhiệt độ nóng chảy thấp, không dẫn điên => Chất cộng hóa trị
Phương pháp giải:
Tham khảo qua sách, báo, tivi, internet…
Trả lời:
- Thành phần của oresol:
+ Sodium chloride: Chất ion
+ Potassium chloride: Chất ion
+ Glucose khan: Chất cộng hóa trị
+ Sodium bicarbonate: Chất ion
- Trong trường hợp không có oresol, có thể hòa tan nửa thìa muối nhỏ (Sodium chloride) và 6 thìa nhỏ đường (thành phần có glucose) trong 1 lít nước đun sôi để nguội. Hoặc có thể sử dụng nước dừa, nước cơm (thành phần có glucose) thêm một chút xíu muối (sodium chloride) để thay thế trong trường hợp khẩn cấp
Bài tập (trang 44)
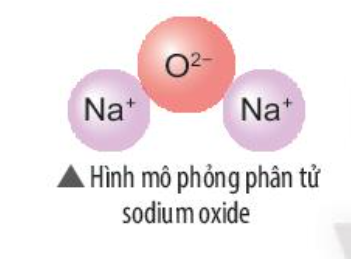
Phương pháp giải:
- Sodium oxide gồm 2 nguyên tố: Na (kim loại) và O (phi kim)
- Nguyên tử Na nhường 1 electron => Ion Na+
- Nguyên tử O nhận 2 electron => Ion O2-
Trả lời:
- Sodium oxide gồm 2 nguyên tố: Na (kim loại) và O (phi kim)
=> Liên kết ion
- Nguyên tử Na (số hiệu nguyên tử = 11) nhường 1 electron => Ion Na+
- Nguyên tử O (số hiệu nguyên tử = 8) nhận 2 electron => Ion O2-
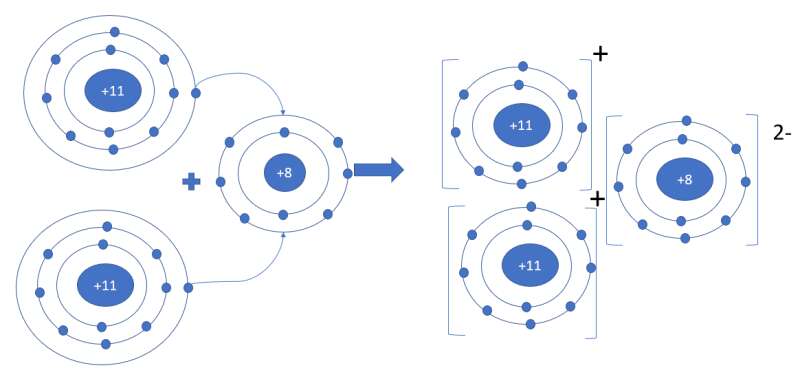
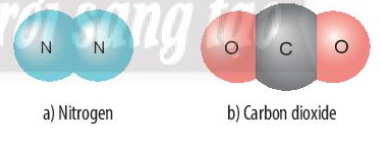
Phương pháp giải:
- N nằm ở ô số 7
- C nằm ở ô số 6
- O nằm ở ô số 8
Trả lời:
- Nguyên tử N nằm ở ô số 7, nhóm VA => Có 5 electron ở lớp ngoài cùng, cần 3 electron để đạt cấu hình khí hiếm
- Nguyên tử C nằm ở ô số 6, nhóm IVA => Có 4 electron ở lớp ngoài cùng, cần 4 electron để đạt cấu hình khí hiếm
- Nguyên tử O nằm ở ô số 8, nhóm VIA => Có 6 electron ở lớp ngoài cùng, cần 2 electron để đạt cấu hình khí hiếm
a) Xét phân tử Nitrogen: gồm 2 nguyên tử N
=> Liên kết cộng hóa trị, mỗi N góp 3 electron tạo thành 3 cặp electron dùng chung
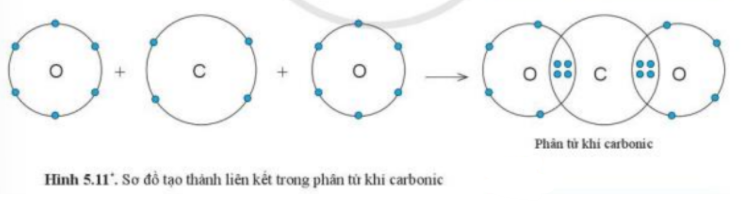
b) Xét phân tử Carbon dioxide: gồm 1 nguyên tử C và 2 nguyên tử O
=> Liên kết cộng hóa trị. Khi C kết hợp với O, nguyên tử C góp 4 electron, mỗi nguyên tử O góp 2 electron
=> Giữa nguyên tử C và nguyên tử O có 2 cặp electron dùng chung
Bài 3 trang 44 KHTN lớp 7: Potassium chloride là hợp chất có nhiều ứng dụng trong đời sống.
Trong nông nghiệp, nó được dùng làm phân bón. Trong công nghiệp, potassium chloride được dùng làm nguyên liệu để sản xuất potassium hydroxide và kim loại potassium. Trong y học, potassium chloride được dùng để bào chế thuốc điều trị bệnh thiếu kali trong máu. Potassium chloride rất cần thiết cho cơ thể, trong các chức năng hoạt động của hệ tiêu hóa, tim, thân, cơ và cả hệ thần kinh.
Hợp chất potassium chloride có loại liên kết gì trong phân tử? Vẽ sơ đồ hình thành liên kết có trong phân tử này.

Phương pháp giải:
- Chất ion là chất được tạo bởi các ion dương và ion âm (giữa kim loại và phi kim)
- Chất cộng hóa trị là chất được tạo thành nhờ liên kết cộng hóa trị (giữa các phi kim)
Trả lời:
- Potassium chloride gồm 2 nguyên tử: K (kim loại) và Cl (phi kim)
=> Liên kết ion
- Nguyên tử K nhường 1 electron cho nguyên tử Cl
Lý thuyết KHTN 7 Bài 6: Giới thiệu về liên kết hóa học
I. Vỏ nguyên tử khí hiếm
- Nhóm khí hiếm là nhóm các nguyên tố hoạt động hóa học kém.
Nhóm khí hiếm gồm: helium (He); neon (Ne); argon (Ar); krypton (Kr); xenon (Xe), …
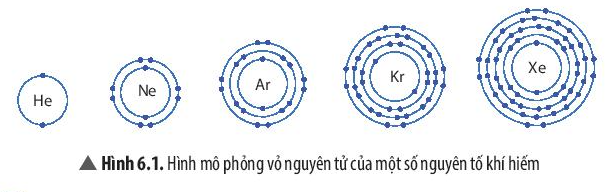
- Vỏ nguyên tử của các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng, riêng helium ở lớp ngoài cùng có 2 electron.
Chú ý:
Để có số electron ở lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm, các nguyên tử của các nguyên tố có khuynh hướng nhường hoặc nhận hoặc góp chung electron.
+ Nguyên tử của các nguyên tố kim loại thường có khuynh hướng nhường electron ở lớp ngoài cùng.
+ Nguyên tử của các nguyên tố phi kim thường có khuynh hướng nhận thêm hoặc góp chung electron để có lớp electron ngoài cùng bền vững.
II. Liên kết ion
1. Sự tạo thành ion dương
- Các nguyên tử của nguyên tố kim loại thường có xu hướng nhường electron ở lớp ngoài cùng để có lớp electron ngoài cùng giống nguyên tử của nguyên tố khí hiếm gần nhất trong bảng tuần hoàn.
- Nguyên tử kim loại khi nhường electron sẽ tạo thành ion dương tương ứng.
Ví dụ: Nguyên tử magnesium nhường 2 electron lớp ngoài cùng tạo thành ion magnesium. Ion magnesium là ion dương, có 8 electron lớp ngoài cùng, cấu hình electron giống với khí hiếm Ne.
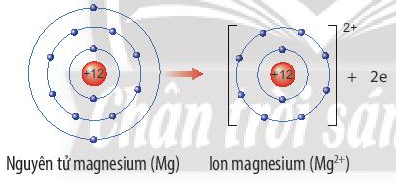
Hay viết gọn: Mg → Mg2+ + 2e
2. Sự tạo thành ion âm
- Các nguyên tử của nguyên tố phi kim (Cl, O, N …) có số electron lớp ngoài cùng là 7, 6, 5, … nên khi kết hợp với các nguyên tử kim loại, nguyên tử phi kim có xu hướng nhận electron từ nguyên tử kim loại để có lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm gần nhất trong bảng tuần hoàn.
- Nguyên tử phi kim khi nhận electron sẽ tạo thành ion âm tương ứng.
Ví dụ: Nguyên tử oxygen nhận thêm 2 electron vào lớp ngoài cùng tạo thành ion oxygen. Ion oxygen có 8 electron lớp ngoài cùng, cấu hình electron giống với nguyên tử khí hiếm Ne.

Hay viết gọn: O + 2e → O2-
3. Sự tạo thành liên kết ion
- Khi nguyên tử kim loại kết hợp với nguyên tử phi kim, nguyên tử kim loại nhường electron tạo thành ion dương, đồng thời nguyên tử phi kim nhận electron tạo thành ion âm.
- Ion âm và ion dương mang điện tích trái dấu, hút nhau, tạo thành liên kết ion.
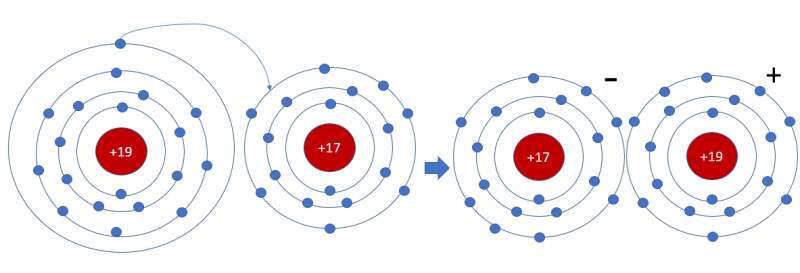
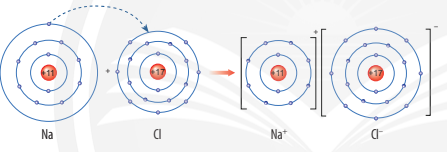
Ví dụ 1: Sơ đồ tạo thành liên kết ion trong phân tử NaCl (sodium chloride).
Nguyên tử sodium nhường 1 electron tạo thành ion sodium (điện tích dương), nguyên tử chlorine nhận 1 electron tạo thành ion chlorine (điện tích âm), hai ion trên trái dấu nên hút nhau tạo thành phân tử sodium chlorine.
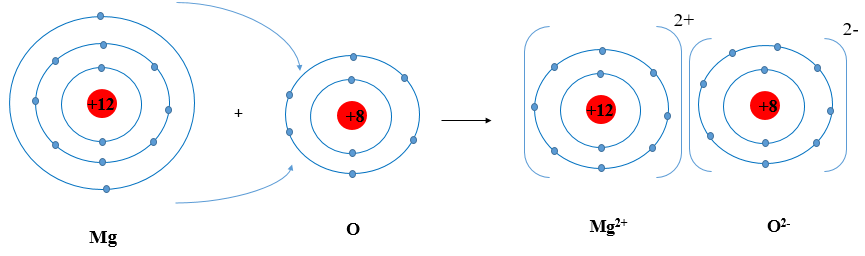
Ví dụ 2: Sơ đồ tạo thành liên kết ion trong phân tử MgO (magnesium oxide).
Nguyên tử magnesium nhường 2 electron tạo thành ion magnesium (điện tích dương), nguyên tử oxygen nhận 2 electron tạo thành ion oxygen (điện tích âm), hai ion trên trái dấu nên hút nhau tạo thành phân tử magnesium oxide
Kết luận:
- Liên kết ion là liên kết giữa ion dương và ion âm.
- Các ion dương và ion âm đơn nguyên tử có lớp electron ngoài cùng giống với nguyên tử của nguyên tố khí hiếm.
III. Liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được hình thành bởi sự dùng chung electron giữa hai nguyên tử.
- Liên kết cộng hóa trị thường là liên kết giữa hai nguyên tử của nguyên tố phi kim với phi kim.
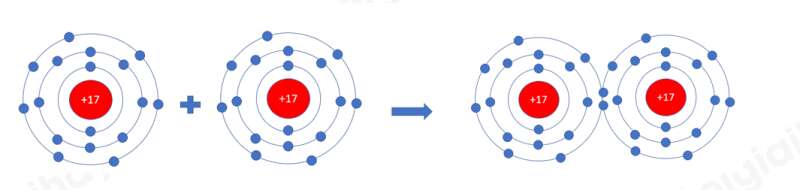
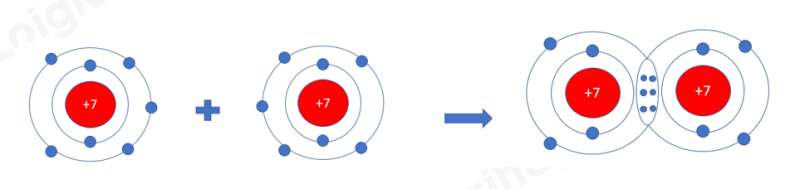
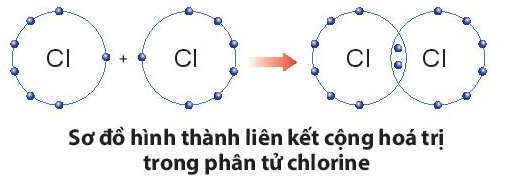
Ví dụ 1: Quá trình tạo thành liên kết cộng hóa trị trong phân tử chlorine:
+ Nguyên tử Cl có 7 electron lớp ngoài cùng và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử Cl liên kết với nhau, mỗi nguyên tử góp 1 electron để tạo ra đôi electron dùng chung.
+ Hạt nhân của hai nguyên tử Cl cùng hút đôi electron dùng chung và liên kết với nhau tạo thành phân tử chlorine.
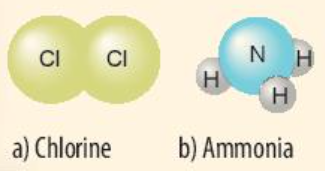
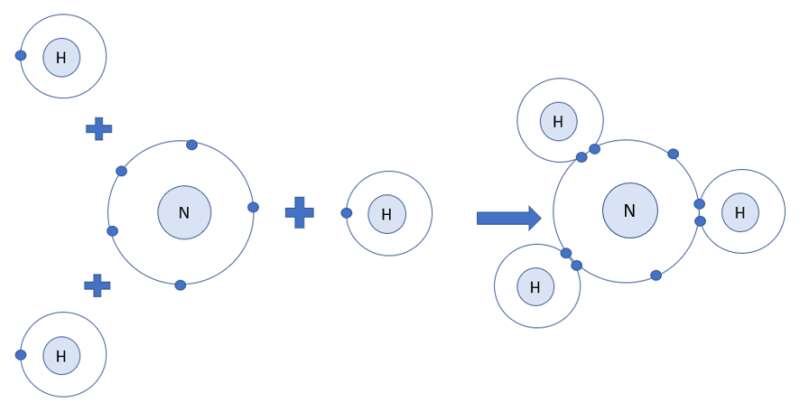
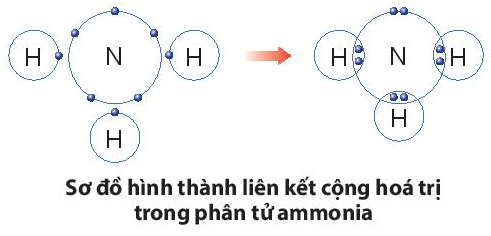
Ví dụ 2: Quá trình tạo thành liên kết cộng hóa trị trong phân tử ammonia:
+ Nitrogen thuộc nhóm VA, có 5 electron lớp ngoài cùng, nguyên tử nitrogen sẽ góp chung 3 electron.
+ Hydrogen thuộc nhóm IA, có 1 electron lớp ngoài cùng, mỗi nguyên tử hydrogen sẽ góp chung 1 electron, theo sơ đồ sau:
IV. Chất ion, chất cộng hóa trị
- Chất được tạo bởi các ion dương và ion âm được gọi là chất ion.
Ví dụ một số hợp chất ion:

- Chất được tạo thành nhờ liên kết cộng hóa trị được gọi là chất cộng hóa trị.
Ví dụ một số hợp chất cộng hóa trị:

- Ở điều kiện thường, chất ion thường ở thể rắn, chất cộng hóa trị ở thể rắn, thể lỏng hoặc thể khí.
V. Một số tính chất của chất ion và chất cộng hóa trị
- Chất ion khó bay hơi, khó nóng chảy, khi tan trong nước tạo dung dịch dẫn được điện.
- Chất cộng hóa trị thường dễ bay hơi, kém bền với nhiệt; một số chất tan được trong nước thành dung dịch. Tùy thuộc vào chất cộng hóa trị khi tan trong nước mà dung dịch thu được có thể dẫn điện hoặc không dẫn điện.
- Ví dụ 1: Dung dịch nước muối dẫn điện còn dung dịch nước đường thì không dẫn điện.
Ví dụ 2: Đường nóng chảy và biến đổi thành chất khác có màu đen. Muối ăn không bị nóng chảy.
Xem thêm các bài giải SGK Khoa học tự nhiên lớp 7 Chân trời sáng tạo hay, chi tiết khác:
Bài 5: Phân tử - Đơn chất - Hợp chất
Bài 7: Hóa trị và công thức hóa học
Bài 9: Đồ thị quãng đường - thời gian