Lời giải bài tập Khoa học tự nhiên lớp 7 Bài 4: Sơ lược bảng tuần hoàn các nguyên tố hóa học sách Chân trời sáng tạo hay, ngắn gọn sẽ giúp học sinh dễ dàng trả lời câu hỏi KHTN 7 Bài 4 từ đó học tốt môn Khoa học tự nhiên 7.
Giải bài tập KHTN lớp 7 Bài 4: Sơ lược bảng tuần hoàn các nguyên tố hóa học
Trả lời:
- Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn:
+ Các nguyên tố hóa học trong bảng tuần hoàn được sắp xếp theo chiều tăng dần điện tích hạt nhân của nguyên tử
+ Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được xếp thành một hàng
+ Các nguyên tố có tính chất hóa học tương tự nhau được xếp thành một cột
- Từ bảng tuần hoàn các nguyên tố hóa học, ta biết được các thông tin:
+ Số hiệu nguyên tử
+ Kí hiệu nguyên tố hóa học
+ Tên nguyên tố
+ Khối lượng nguyên tử
1. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hóa học
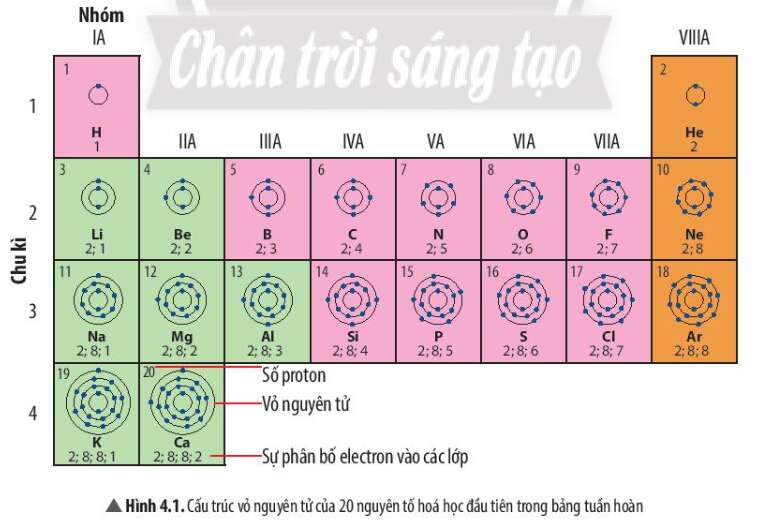
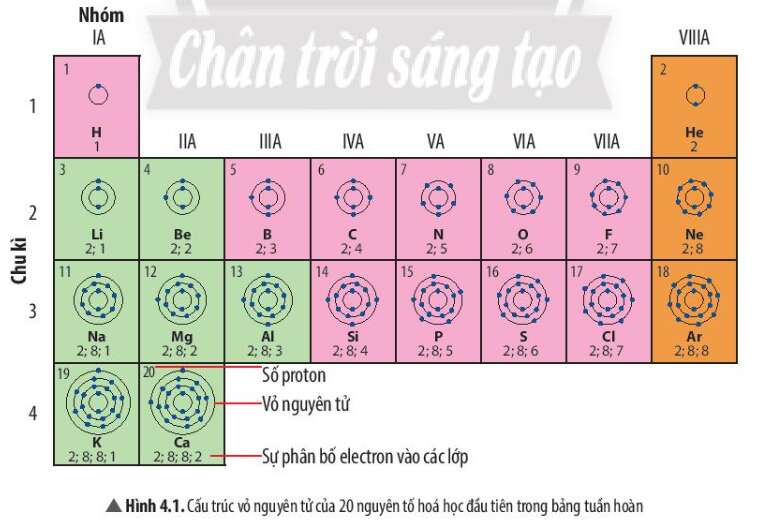
Câu hỏi thảo luận 1 trang 23 KHTN lớp 7: Quan sát Hình 4.1, em hãy cho biết
a) nguyên tử của những nguyên tố nào có cùng số lớp electron
b) nguyên tử của những nguyên tố nào có số electron ở lớp ngoài cùng bằng nhau
Phương pháp giải:
- Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng
- Các nguyên tố có tính chất hóa học tương tự nhau được xếp thành 1 cột
Trả lời:
a) Những nguyên tố nằm ở cùng 1 chu kì có số lớp electron bằng nhau
- Ví dụ: Các nguyên tố ở chu kì 1 có 1 lớp electron, các nguyên tố ở chu kì 2 có 2 lớp electron, nguyên tố ở chu kì 3 có 3 lớp electron
b) Những nguyên tố nằm ở cùng 1 nhóm có số electron ở lớp ngoài cùng bằng nhau
- Ví dụ: Các nguyên tố nhóm IA có 1 electron ở lớp ngoài cùng, nguyên tố nhóm VIIA có 7 electron ở lớp ngoài cùng
- Trừ nguyên tố He nằm ở nhóm VIIIA nhưng có 2 electron ở lớp ngoài cùng
Luyện tập trang 23 KHTN lớp 7: Dựa vào cơ sở nào để xếp các nguyên tố hóa học trong bảng tuần hoàn
Phương pháp giải:
- Dựa vào điện tích hạt nhân, số electron lớp ngoài cùng, số lớp electron
Trả lời:
- Cơ sở để xếp các nguyên tố hóa học trong bảng tuần hoàn là:
+ Các nguyên tố hóa học trong bảng tuần hoàn được sắp xếp theo chiều tăng dần điện tích hạt nhân của nguyên tử
+ Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được xếp thành một hàng
+ Các nguyên tố có tính chất hóa học tương tự nhau được xếp thành một cột
2. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Phương pháp giải:
- Gồm các nguyên tố hóa học, mỗi nguyên tố nằm ở 1 ô
- Nguyên tố họ lanthanide và họ actinide được xếp riêng thành 2 hàng ở cuối bảng
Trả lời:
- Bảng tuần hoàn gồm các nguyên tố hóa học mà vị trí được đặc trưng bởi ô nguyên tố, chu kì và nhóm
- Các nguyên tố họ lanthanide và họ actinide được xếp riêng thành 2 hàng ở cuối bảng tuần hoàn
Phương pháp giải:
Số hiệu nguyên tử = số đơn vị điện tích hạt nhân
Trả lời:
- Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số proton trong hạt nhân = số electron trong nguyên tử = số thứ tự của nguyên tố trong bảng tuần hoàn
- Ví dụ: Nguyên tử hydrogen có số hiệu nguyên tử là 1
=> Nguyên tố hydrogen ở ô số 1 trong bảng tuần hoàn, điện tích hạt nhân là +1 (do có 1 proton trong hạt nhân) cà có 1 electron trong nguyên tử
Luyện tập trang 25 KHTN lớp 7: Cho biết những thông tin cơ bản về nguyên tố hóa học đã cho dưới đây
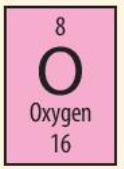
Phương pháp giải:
Tham khảo Hình 4.3
Trả lời:
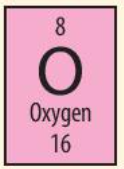
Cho biết:
+ Nguyên tố oxygen có kí hiệu hóa học là O
+ Khối lượng nguyên tử oxygen là 16
+ Số hiệu nguyên tử là 8 => Nguyên tố oxygen ở ô số 8 trong bảng tuần hoàn, điện tích hạt nhân là +8 (do có 8 proton trong hạt nhân) và có 8 electron trong nguyên tử
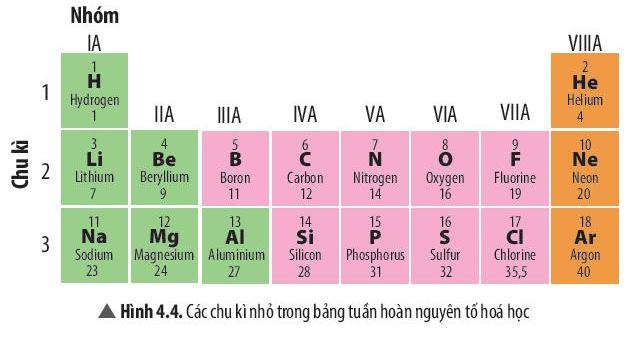
Câu hỏi thảo luận 4 trang 25 KHTN lớp 7: Quan sát Hình 4.4 và trả lời các câu hỏi sau:
a) Mỗi chu kì bắt đầu từ nhóm nào và kết thúc ở nhóm nào?
b) Em hãy chỉ ra sự tuần hoàn ở mỗi chu kì trong bảng tuần hoàn các nguyên tố hóa học.

Phương pháp giải:
a) Quan sát Hình 4.4 để trả lời câu hỏi
b) Trong cùng 1 chu kì, xét từ trái qua phải, số electron lớp ngoài cùng tăng dần từ 1 đến 8
Trả lời:
a) Mỗi chu kì bắt đầu từ nhóm IA và kết thúc ở nhóm VIIIA
b)
- Trong 1 chu kì, xét từ trái qua phải, số electron ở lớp ngoài cùng tăng dần từ 1 đến 8
- Khi bắt đầu 1 chu kì mới, nguyên tố đầu tiên có 1 electron ở lớp ngoài cùng tương ứng với nhóm IA và tăng dần đến 8 tương ứng với nhóm VIIIA

Phương pháp giải:
Nhóm là tập hợp các nguyên tố có tính chất hóa học tương tự nhau và được xếp thành cột, theo chiều tăng dần về điện tích hạt nhân
Trả lời:
- Các nguyên tố trong cùng 1 nhóm (cùng 1 cột dọc) sẽ có tính chất hóa học tương tự nhau
=> Các nguyên tố nhóm IA (trừ H) đều là nguyên tố kim loại hoạt động mạnh
Các nguyên tố nhóm VIIA đều là nguyên tố phi kim hoạt động mạnh
Các nguyên tố nhóm VIIIA đều là các khí hiếm, trơ, không tham gia các phản ứng
| Nguyên tố | Kí hiệu hóa học | Nhóm | Chu kì |
| Calcium | ? | ? | ? |
| ? | P | ? | ? |
| Xenon | ? | ? | ? |
Phương pháp giải:
- Nhóm là cột dọc
- Chu kì là hàng ngang
Trả lời:
| Nguyên tố | Kí hiệu hóa học | Nhóm | Chu kì |
| Calcium | Ca | IIA | 4 |
| Phosphorus | P | VA | 3 |
| Xenon | Xe | VIIIA | 5 |
3. Các nguyên tố kim loại
Phương pháp giải:
- Nhóm là cột dọc
- Chu kì là hàng ngang
Trả lời:
- Nguyên tố K
+ Số thứ tự ô: 19
+ Nhóm: IA
+ Chu kì: 4
- Nguyên tố Mg
+ Số thứ tự ô: 12
+ Nhóm: IIA
+ Chu kì: 3
- Nguyên tố Al
+ Số thứ tự ô: 13
+ Nhóm: IIIA
+ Chu kì: 3
Phương pháp giải:
- Nguyên tố Mercury (thủy ngân) tồn tại ở thể lỏng trong điều kiện thường
- Quan sát bảng tuần hoàn ở Hình 4.2 để xác định vị trí
Trả lời:
- Kim loại ở thể lỏng trong điều kiện thường, được ứng dụng để chế tạo nhiệt kế là: Mercury (thủy ngân) có kí hiệu hóa học là Hg
- Mercury nằm ở nhóm IIB, chu kì 6 (hàng số 6)
Phương pháp giải:
Những kim loại thường được sử dụng để làm trang sức là: Gold, Silver, Platinum
Trả lời:
- Gold (vàng): Kí hiệu hóa học là Au
+ Số thứ tự ô: 79
+ Nhóm: IB
+ Chu kì: 6
- Silver (bạc): Kí hiệu hóa học là Ag
+ Số thứ tự ô: 47
+ Nhóm: IB
+ Chu kì: 5
- Platinum (bạch kim): Kí hiệu hóa học là Pt
+ Số thứ tự ô: 78
+ Nhóm: VIIIB
+ Chu kì: 6
4. Các nguyên tố phi kim
Phương pháp giải:
Tham khảo bảng tuần hoàn ở Hình 4.2
- Nhóm là cột dọc
- Chu kì là hàng ngang
Trả lời:
- Nguyên tố carbon: Nằm ở nhóm IVA, chu kì 2
- Nguyên tố nitrogen: Nằm ở nhóm VA, chu kì 2
- Nguyên tố oxygen: Nằm ở nhóm VIA, chu kì 2
- Nguyên tố chlorine: Nằm ở nhóm VIIA, chu kì 3
Phương pháp giải:
- Nguyên tố phi kim có trong thành phần kem đánh răng là: fluorine
- Thành phần chính của muối ăn là: sodium chloride => Nguyên tố phi kim trong muối ăn là chlorine
Trả lời:
- Nguyên tố phi kim có trong thành phần kem đánh răng là: fluorine có kí hiệu hóa học là F
+ Nhóm VIIA
+ Chu kì: 2
- Thành phần chính của muối ăn là: sodium chloride
=> Nguyên tố phi kim trong muối ăn là chlorine có kí hiệu hóa học là Cl
+ Nhóm VIIA
+ Chu kì: 3
5. Nhóm các nguyên tố khí hiếm
Phương pháp giải:
Nguyên tố khí hiếm thuộc nhóm VIIIA trong bảng tuần hoàn
Trả lời:
- Nguyên tố khí hiếm thuộc nhóm VIIIA trong bảng tuần hoàn
- Các nguyên tố thuộc nhóm VIIIA (trừ He) đều có 8 electron ở lớp ngoài cùng
=> Ngoài He có 2 electron ở lớp ngoài cùng thì các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng

Phương pháp giải:
- Khí oxygen nặng hơn không khí
- Khí hydrogen dễ gây cháy nổ khi tiếp xúc với khí oxygen
Trả lời:
- Người ta đã bơm vào khinh khí cầu khí helium vì helium nhẹ hơn không khí và kém hoạt động, không gây cháy nổ
- Không sử dụng khí oxygen vì khí oxygen nặng hơn không khí, khinh khí cầu không thể bay lên được
- Không sử dụng khí hydrogen vì khí hydrogen dễ gây cháy nổ khi tiếp xúc với khí oxygen (có nhiệt độ)
Bài tập (trang 30)
Bài 1 trang 30 KHTN lớp 7: Trong bảng tuần hoàn, các nguyên tố hóa học được sắp xếp theo
A. thứ tự chữ cái trong từ điển
B. thứ tự tăng dần điện tích hạt nhân
C. thứ tự tăng dần số hạt electron lớp ngoài cùng
D. thứ tự tăng dần số hạt neutron
Phương pháp giải:
Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn: theo chiều tăng dần điện tích hạt nhân của nguyên tử
Trả lời:
- Các nguyên tố hóa học trong bảng tuần hoàn được sắp xếp theo chiều tăng dần điện tích hạt nhân của nguyên tử
=> Đáp án B
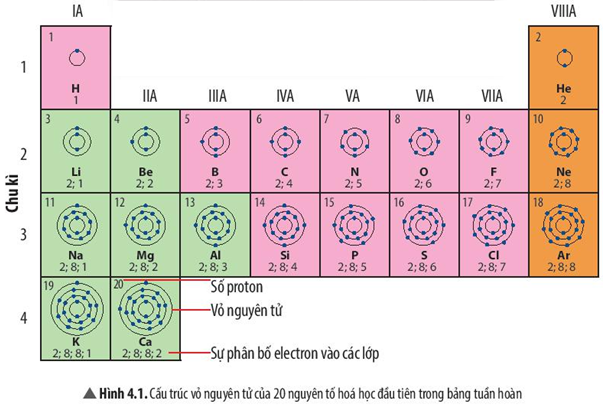
Bài 2 trang 30 KHTN lớp 7: Những nguyên tố hóa học nào sau đây thuộc cùng một nhóm?
A. O, S, Se
B. N, O, F
C. Na, Mg, K
D. Ne, Na, Mg
Phương pháp giải:
- Quan sát Hình 4.2
- Các nguyên tố cùng 1 nhóm là cùng 1 cột dọc
Trả lời:
A: O, S, Se thuộc cùng nhóm VIA
B: N thuộc nhóm VA, O thuộc nhóm VIA, F thuộc nhóm VIIA
C: Na, K thuộc nhóm IA, Mg thuộc nhóm IIA
D: Ne thuộc nhóm VIIIA, Na thuộc nhóm IA, Mg thuộc nhóm IIA
=> Đáp án A
Bài 3 trang 30 KHTN lớp 7: Những nguyên tố hóa học nào sau đây thuộc cùng một chu kì?
A. Li, Si, Ne
B. Mg, P, Ar
C. K, Fe, Ag
D. B, Al, In
Phương pháp giải:
- Quan sát Hình 4.2
- Các nguyên tố cùng 1 chu kì là cùng 1 hàng ngang
Trả lời:
A: Li thuộc chu kì 2, Si thuộc chu kì 3, Ne thuộc chu kì 2
B: Mg, P, Ar đều thuộc chu kì 3
C: K, Fe thuộc chu kì 4, Ag thuộc chu kì 5
D: B thuộc chu kì 2, Al thuộc chu kì 3, In thuộc chu kì 5
=> Đáp án B
| Kim loại | Phi kim | Khí hiếm |
| ? | ? | ? |
Phương pháp giải:
- Quan sát Hình 4.2:
+ Ô màu xanh: Kim loại
+ Ô màu hồng: Phi kim
+ Ô màu cam: Khí hiếm
Trả lời:
| Kim loại | Phi kim | Khí hiếm |
| Ge, Pb, Mo, Ba, Hg | S, Br, C | Ar |
a) Magnesium (Mg)
b) Neon (Ne)
Phương pháp giải:
- Quan sát bảng tuần hoàn ở Hình 4.2
+ Ô nguyên tố = số hiệu nguyên tử
+ Chu kì là hàng ngang
+ Nhóm là cột dọc
Trả lời:
a) Nguyên tố Magnesium (Mg)
+ Ô nguyên tố: 12
+ Chu kì: 3
+ Nhóm: IIA
b) Nguyên tố Neon (Ne)
+ Ô nguyên tố: 10
+ Chu kì: 2
+ Nhóm: VIIIA
Phương pháp giải:
Khí oxygen rất cần thiết cho sự hô hấp của con người và sinh vật trên Trái Đất
Trả lời:
- Ở điều kiện thường là chất khí, không màu, không mùi, không vị
- Nặng hơn không khí
- Ít tan trong nước (1L nước ở 20oC, 1 atm hòa tan được 31 mL khí oxygen)
- Oxygen hóa lỏng ở -183oC, hóa rắn ở -218oC. Ở thể lỏng và rắn, oxygen có màu xanh nhạt.
Oxygen cần thiết cho sự sống
- Oxygen là thành phần quan trọng nhất đối với hoạt động hô hấp của con người, động vật, thực vật
- Oxygen có ở mọi nơi: trong không khí, nước, đất
Oxygen cần thiết cho sự cháy và quá trình đốt cháy nhiên liệu
- Oxygen cần cho quá trình đốt cháy nhiên liệu như củi, than đá, dầu mỏ, khí thiên nhiên,…
- Trong công nghiệp sản xuất gang thép, người ta thổi khí oxi để tạo ra nhiệt độ cao, nâng hiệu suất và chất lượng gang thép.
- Chế tạo mìn phá đá.
- Oxi lỏng dùng để đốt nhiên liệu trong tên lửa.
Lý thuyết KHTN 7 Bài 4: Sơ lược bảng tuần hoàn các nguyên tố hóa học
I. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hóa học
- Cơ sở chính để sắp xếp các nguyên tố hóa học vào bảng tuần hoàn các nguyên tố hóa học (gọi tắt là bảng tuần hoàn) là dựa vào điện tích hạt nhân nguyên tử.
- Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn:
+ Các nguyên tố hóa học được sắp xếp theo chiều tăng dần điện tích hạt nhân của nguyên tử.
+ Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
+ Các nguyên tố có tính chất hóa học tương tự nhau được xếp thành một cột.
II. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
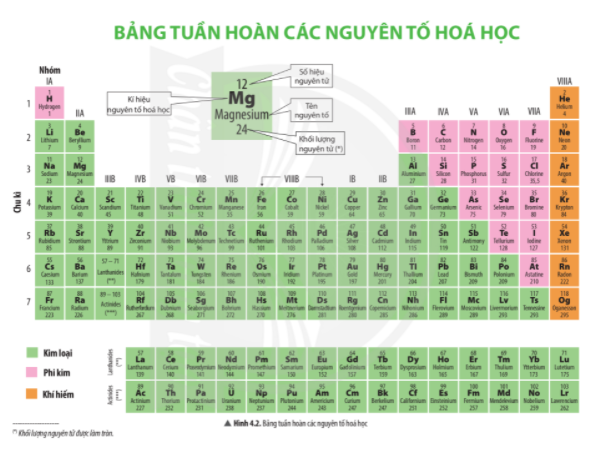
1. Mô tả cấu tạo của bảng tuần hoàn các nguyên tố hóa học
- Bảng tuần hoàn gồm các nguyên tố hóa học mà vị trí được đặc trưng bởi ô nguyên tố, chu kì và nhóm.
- Các nguyên tố họ lanthanide và họ actinide được xếp riêng thành 2 hàng ở cuối bảng tuần hoàn.
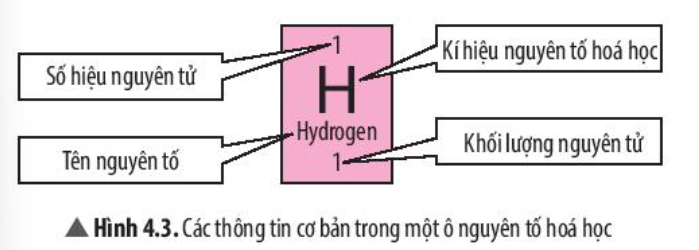
2. Ô nguyên tố
- Trong bảng tuần hoàn, mỗi ô nguyên tố cho biết các thông tin cần thiết về một nguyên tố hóa học.
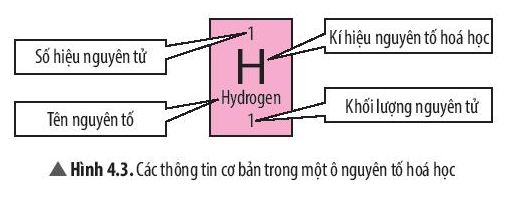
- Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân (bằng số proton trong hạt nhân) và bằng số electron của nguyên tử.
- Số hiệu nguyên tử cũng là số thứ tự của nguyên tố trong bảng tuần hoàn.
Ví dụ: Dựa vào ô nguyên tố số 8 trong bảng tuần hoàn ta biết được:
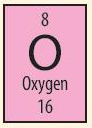
+ Số hiệu nguyên tử: 8
+ Kí hiệu hóa học: O
+ Tên nguyên tố: oxygen
+ Khối lượng nguyên tử: 16 amu
+ Ngoài ra:
Điện tích hạt nhân = +8.
Số đơn vị điện tích hạt nhân = số proton = số electron = 8
3. Chu kì trong bảng tuần hoàn các nguyên tố hóa học
- Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được sắp xếp vào cùng một hàng ngang trong bảng tuần hoàn được gọi là chu kì.
- Hiện nay, bảng tuần hoàn gồm có 7 chu kì, xét về số lượng các nguyên tố trong mỗi chu kì thì chu kì được chia thành:
+ Chu kì nhỏ gồm các chu kì 1, 2, 3.
+ Chu kì lớn gồm các chu kì 4, 5, 6, 7.
- Số thứ tự chu kì = số lớp electron.
4. Nhóm trong bảng tuần hoàn các nguyên tố hóa học
- Nhóm là tập hợp các nguyên tố có tính chất hóa học tương tự nhau và được xếp thành cột, theo chiều tăng dần về điện tích hạt nhân.
- Số thứ tự nhóm được kí hiệu bằng các chữ số La Mã từ I đến VIII.

Ví dụ:
+ Nhóm IA gồm các nguyên tố kim loại hoạt động mạnh (trừ H). Nguyên tử của chúng đều có 1 electron ở lớp ngoài cùng. Điện tích hạt nhân tăng từ Li (+3) đên Fr (+87).
+ Nhóm VIIA gồm các nguyên tố phi kim hoạt động mạnh (trừ At, Ts). Nguyên tử của chúng đều có 7 electron ở lớp ngoài cùng. Điện tích hạt nhân tăng từ F (+9) đến Ts (+117).
III. Các nguyên tố kim loại
1. Các nguyên tố kim loại nhóm A
- Các nguyên tố kim loại nhóm A gồm nhóm IA (trừ nguyên tố hydrogen); nhóm IIA, nhóm IIIA (trừ nguyên tố boron), …
- Các nguyên tố kim loại thuộc nhóm IA được gọi là nhóm kim loại kiềm.

- Các nguyên tố kim loại thuộc nhóm IIA được gọi là nhóm kim loại kiềm thổ.

2. Các nguyên tố kim loại nhóm B
- Các nguyên tố nhóm B đều là kim loại, mỗi nhóm B tương ứng với một cột trong bảng tuần hoàn (trừ nhóm VIIIB có 3 cột).
- Một số kim loại nhóm B có ứng dụng rộng rãi trong đời sống hàng ngày như:
+ Iron: Làm vật liệu xây dựng, đồ dùng trong gia đình như dao, kéo, búa, kệ sắt, cửa sắt, bàn ghế, … Làm khung cho các loại máy móc, phương tiện giao thông, ...

+ Copper: Làm dây dẫn điện, đúc tượng, làm xoong nồi, …

+ Silver: làm đồ trang sức, linh kiện điện tử, sử dụng trong nha khoa để bọc răng, sản xuất các loại thuốc, chất giặt rửa ứng dụng công nghệ nano bạc, …

Chú ý: Hơn 80% các nguyên tố hóa học trong bảng tuần hoàn là kim loại, bao gồm một số nguyên tố nhóm A và tất cả các nguyên tố nhóm B.
IV. Các nguyên tố phi kim
1. Vị trí
- Nhóm nguyên tố phi kim chủ yếu tập trung ở góc bên phải của bảng tuần hoàn các nguyên tố hóa học.
- Các nguyên tố phi kim bao gồm:
+ Nguyên tố hydrogen ở nhóm IA.
+ Một số nguyên tố ở nhóm IIIA và IVA.
+ Hầu hết các nguyên tố thuộc nhóm VA, VIA và VIIA.
2. Tính chất
- Ở điều kiện thường, các phi kim có thể ở thể rắn, thể lỏng hoặc thể khí.
- Nhóm nguyên tố phi kim VIIA được gọi là nhóm nguyên tố halogen. Các đơn chất thuộc nhóm halogen có một số đặc điểm như:
+ Có màu sắc đậm dần từ fluorine tới iodine, thể thay đổi từ khí – lỏng – rắn.
+ Độc hại đối với các sinh vật.

V. Nhóm các nguyên tố khí hiếm
1. Vị trí trong bảng tuần hoàn
- Nhóm VIIIA gồm các nguyên tố khí hiếm: Helium (He); Neon (Ne); Argon (Ar); Krypton (Kr); Xenon (Xe); Radon (Rn) và Oganesson (Og – nguyên tố nhân tạo).
2. Tính chất
Ở điều kiện thường, các nguyên tố khí hiếm có những đặc điểm giống nhau như:
+ Chất khí, không màu, tồn tại trong tự nhiên với hàm lượng thấp.
+ Tồn tại dưới dạng đơn nguyên tử.
+ Các nguyên tố của nhóm khí hiếm rất kém hoạt động, hầu như không phản ứng với nhau và với chất khác.
3. Ứng dụng
- Các nguyên tố khí hiếm chiếm tỉ lệ thể tích rất ít trong không khí nhưng có những ứng dụng quan trọng trong đời sống.
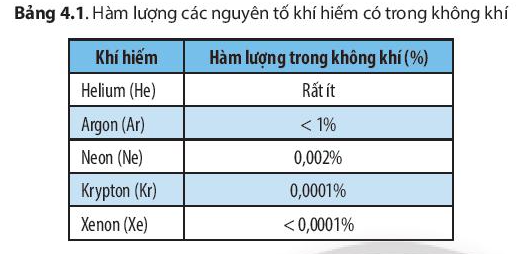
- Khí hiếm được ứng dụng nhiều nhất trong công nghệ chế tạo bóng đèn. Các bóng đèn chứa xenon, argon và neon có thể phát ra ánh sáng với các màu sắc khác nhau.

- Xenon được sử dụng làm khí gây mê toàn phần; ứng dụng trong năng lượng hạt nhân; là tác nhân oxi hóa trong hóa học phân tích; ứng dụng trong tinh thể học protein.
Xem thêm các bài giải SGK Khoa học tự nhiên lớp 7 Chân trời sáng tạo hay, chi tiết khác:
Bài 5: Phân tử - Đơn chất - Hợp chất
Bài 6: Giới thiệu về liên kết hóa học
Bài 7: Hóa trị và công thức hóa học