Tailieumoi.vn xin giới thiệu phương trình Ag2S + O2 2Ag↓ + SO2↑ gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Bạc. Mời các bạn đón xem:
Phương trình Ag2S + O2 2Ag↓ + SO2↑
1. Phương trình phản ứng hóa học:
Ag2S + O2 2Ag↓ + SO2↑
2. Hiện tượng nhận biết phản ứng
Có khí mùi hắc thoát ra
3. Điều kiện phản ứng
Nhiệt độ: 500 – 600oC
4. Tính chất hoá học
a. Tính chất hoá học Ag2S
- Phản ứng khử
Ag2S có thể được khử thành bạc kim loại bằng cách tắm các mảnh màu đen bằng nước nóng, NaOH, nhôm và muối. Phản ứng sau đây diễn ra:
Ag2S (s) + 2Al (s) + 3H2O (l) → 6Ag (s) + 3H2S (ac) + Al2O3(s)
+ Nhiệt phân Ag2S ở nhiệt độ cao
Ag2S → 2Ag + S
+ Nghiền nhỏ quặng bạc sunfua Ag2S, xử lí bằng dung dịch natri xianua, rồi lọc để thu được dung dịch muối phức bạc. Phản ứng tương tự cũng sảy ra với KCN.
Ag2S + 4NaCN → Na2S + 2Na[Ag(CN)2]
Trường hợp có H2O tham gia phản ứng
H2O + Ag2S + 4NaCN → NaOH + NaSH + 2Na[Ag(CN)2]
- Đốt bạc sunfua sản phẩm tạo thành là bạc và khí SO2
O2 + Ag2S → 2Ag + SO2
b. Tính chất hoá học của O2
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
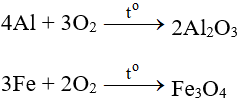
Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
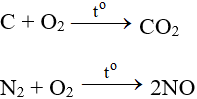
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
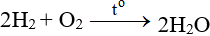
Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
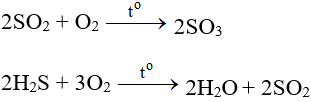
- Tác dụng với các chất hữu cơ:
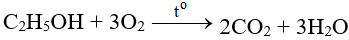
5. Cách thực hiện phản ứng
Đốt cháy Ag2S trong khí oxi dư
6. Bạn có biết
Bạc sunfua (Ag2S) là chất rắn màu đen dày đặc, được hình thành theo thời gian trên đồ bạc và các vật bạc khác, bạc sunfua không hòa tan trong tất cả các dung môi, nhưng bị phân hủy bởi axit mạnh.
7. Bài tập liên quan
Ví dụ 1: Đốt cháy 2,48 gam Ag2S trong khí oxi dư ta thu được m gam Ag. Giá trị m là
A. 1,08
B. 2,16
C. 4,44
D. 1,44
Hướng dẫn giải
Đáp án đúng là: B
Ta có: = 0,01 mol
Phương trình hóa học:
Ag2S + O2 2Ag↓ + SO2 ↑
⇒ nAg = 2. = 2.0,01= 0,02 mol
⇒ mAg = 0,02. 108 = 2,16 gam
Ví dụ 2: Thực hiện các thí nghiệm sau:
1) Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2
2) Đốt cháy Ag2S trong không khí dư
3) Cho Zn vào lượng dư dung dịch CuSO4
4) Cho K2O tác dụng với H2O
Sau khi kết thúc thí nghiệm, số trường hợp tạo ra đơn chất là
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải
Đáp án đúng là: C
1) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
2) Ag2S + O2 2Ag↓ + SO2↑
3) Zn + CuSO4 → ZnSO4 + Cu↓
4) K2O + H2O → 2KOH
Ví dụ 3: Đốt cháy Ag2S trong khí oxi dư ta thu được khí X. Vậy X là
A. S
B. H2S
C. SO2
D. O2
Hướng dẫn giải
Đáp án đúng là: C
Ag2S + O2 2Ag↓ + SO2 ↑
8. Một số phương trình phản ứng hoá học khác của Bạc (Ag) và hợp chất:
2AgNO3 + FeCl2 → Fe(NO3)2 + 2AgCl↓
AgNO3 + NH4Cl → NH4NO3 + AgCl↓
2AgNO3 + H2O + 4NH3 + HCOOH → (NH4)2CO3 + 2Ag↓ + 2NH4NO3