Tailieumoi.vn xin giới thiệu phương trình 4Ag + 2H2S + O2(không khí) → 2Ag2S + 2H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Bạc. Mời các bạn đón xem:
Phương trình 4Ag + 2H2S + O2(không khí) → 2Ag2S + 2H2O
1. Phương trình phản ứng hóa học:
4Ag + 2H2S + O2(không khí) → 2Ag2S + 2H2O
2. Hiện tượng nhận biết phản ứng
- Xuất hiện kết tủa đen
3. Điều kiện phản ứng
- Có hơi ẩm và không khí
4. Tính chất hoá học
a. Tính chất hoá học của Ag
- Bạc kém hoạt động. Ag → Ag+ + 1e
Tác dụng với phi kim
- Bạc không bị oxi hóa trong không khí dù ở nhiệt độ cao.
Tác dụng với ozon
2Ag + O3 → Ag2O + O2
Tác dụng với axit
- Bạc không tác dụng với HCl và H2SO4 loãng, nhưng tác dụng với các axit có tính oxi hóa mạnh, như HNO3hoặc H2SO4 đặc, nóng.
3Ag + 4HNO3 (loãng) → 3AgNO3 + NO + 2H2O
2Ag + 2H2SO4 (đặc, nóng) → Ag2SO4 + SO2 + 2H2O
Tác dụng với các chất khác
- Bạc có màu đen khi tiếp xúc với không khí hoặc nước có mặt hidro sunfua:
4Ag + 2H2S + O2 (kk) → 2Ag2S + 2H2O
- Bạc tác dụng được với axit HF khi có mặt của oxi già:
2Ag + 2HF (đặc) + H2O2 → 2AgF + 2H2O
2Ag + 4KCN (đặc) + H2O2 → 2K[Ag(CN)2] + 2KOH
b. Tính chất hoá học của H2S
Tính axit yếu
Hiđro sunfua tan trong nước tạo thành dung dịch axit rất yếu (yếu hơn axit cacbonic), có tên là axit sunfuhiđric (H2S).
Axit sunfuhiđric tác dụng với kiềm tạo nên 2 loại muối: muối trung hòa, như Na2S chứa ion S2- và muối axit như NaHS chứa ion HS−.
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
Tính khử mạnh
Là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (-2).
Khi tham gia phản ứng hóa học, tùy thuộc vào bản chất và nồng độ của chất oxi hóa, nhiệt độ,...mà nguyên tố lưu huỳnh có số oxi hóa −2 (S-2) có thể bị oxi hóa thành (S0), (S+4), (S+6).
- Tác dụng với oxi có thể tạo S hoặc SO2 tùy lượng ôxi và cách tiến hành phản ứng.
Ở nhiệt độ cao, khí H2S cháy trong không khí với ngọn lửa xanh nhạt, H2S bị oxi hóa thành SO2:
- Tác dụng với clo có thể tạo S hay H2SO4 tùy điều kiện phản ứng.
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
H2S + Cl2 → 2HCl + S (khí clo gặp khí H2S)
c. Tính chất hoá học của O2
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
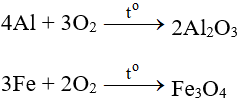
Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
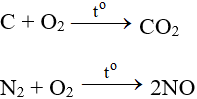
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
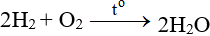
Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
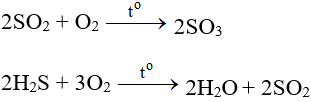
- Tác dụng với các chất hữu cơ:
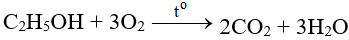
5. Cách thực hiện phản ứng
- Cho kim loại bạc tác dụng với khí hidro sunlfua
6. Bạn có biết
- bạc để trong không khí sẽ bị biến thành màu đen
7. Bài tập liên quan
Ví dụ 1: Cho phản ứng: 4Ag + 2H2S + O2 (không khí) → 2Ag2S + 2H2O. Trong phản ứng trên chất đóng vai trò làm chất khử :
A. H2S
B. Ag
C. O2
D. H2S và Ag
Hướng dẫn:
Ag0 - 1e → Ag+
Đáp án: B
Ví dụ 2: Nếu để đồ trang sức bằng bạc trong không khí thấy đồ trang sức bị biến thành màu đen chứng tỏ trong không khí có chứa chất khí :
A. H2S
B. CO2
C. O2
D. N2
Đáp án: A
Ví dụ 3: Trong các phản ứng sau phản ứng nào tạo kết tủa đen :
A. 2Ag + 2H2SO4 → Ag2SO4 + SO2 + 2H2O
B. Ag + 2HNO3 → AgNO3 + NO2 + H2O
C. 3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
D. 4Ag + 2H2S + O2(không khí) → 2Ag2S + 2H2O
Đáp án: D
8. Một số phương trình phản ứng hoá học khác của Bạc (Ag) và hợp chất:
2Ag + 2HF(đặc) + H2O2 → 2AgF + 2H2O
2AgNO3 + FeCl2 → Fe(NO3)2 + 2AgCl↓
AgNO3 + NH4Cl → NH4NO3 + AgCl↓
2AgNO3 + H2O + 4NH3 + HCOOH → (NH4)2CO3 + 2Ag↓ + 2NH4NO3