Tailieumoi.vn xin giới thiệu phương trình 2Al2S3 + 9O2 → 2Al2O3 + 6SO2↑ gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Nhôm. Mời các bạn đón xem:
Phương trình 2Al2S3 + 9O2 → 2Al2O3 + 6SO2↑
1. Phương trình phản ứng hóa học:
2Al2S3 + 9O2 → 2Al2O3 + 6SO2↑
2. Hiện tượng nhận biết phản ứng
- Phản ứng tạo thành nhôm oxit và lưu huỳnh đioxit
3. Điều kiện phản ứng
- Nhiệt độ: 700 - 800oC
4. Tính chất hoá học
a. Tính chất hoá học của Al2S3
- Tác dụng với nước
Al2S3 + H2O → Al(OH)3 + H2S
- Tác dụng với axit
Al2S3 + HCl → AlCl3 + H2S
- Tác dụng với dung dịch bazo
Al2S3 + NaOH → Al(OH)3 + Na2S
- Tác dụng với dung dịch muối
Al2S3 + Cu(NO3)2 → Al(NO3)3 + CuS
b. Tính chất hoá học của O2
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
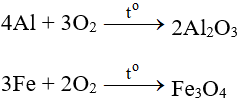
Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
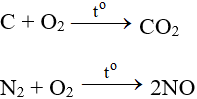
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
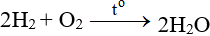
Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
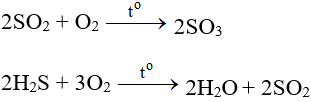
- Tác dụng với các chất hữu cơ:
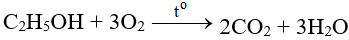
5. Cách thực hiện phản ứng
- Cho Al2S3 tác dụng với oxi
6. Bài tập liên quan
Ví dụ 1: Phát biểu nào sau đây là sai ?
A. Dung dịch AlCl3 và Al2(SO3)3 làm quỳ tím hóa hồng
B. Al(OH)3, Al2O3, Al đều là các chất lưỡng, tính,
C. Nhôm là kim loai nhẹ và có khả năng dẫn điện Iot
D. Từ Al2O3 có thế điều chế được Al.
Đáp án: B
Ví dụ 2: Dùng hóa chất nào sau đây để phân biệt Zn(NO3)2 và Al(NO3)3 ?
A. Dung dịch NaOH
B. Dung dịch Ba(OH)2
C. Dung dịch NH3
D. Dung dịch nước vôi trong
Đáp án: C
Hướng dẫn giải
Khi cho NH3 vào 2 dung dịch cả 2 dung dịch đều xuất hiện kết tủa hidroxit, nhưng Zn(OH)2 tạo thành có khả năng tạo phức với NH3 nên kết tủa lại tan, còn với Al(OH)3 không tan trong NH3
Ví dụ 3: Kết luận nào sau đây không đúng với nhôm?
A. Có bán kính nguyên tử lớn hơn Mg.
B. Là nguyên tố họ p.
C. Là kim loại mà oxit và hidroxit lưỡng tính.
D. Trạng thái cơ bản nguyên tử có 1e độc thân.
Đáp án: A
Hướng dẫn giải
Mg thuộc nhóm IIA, Al thuộc nhóm IIIA và cùng thuộc chu kì 3 → bán kính của Mg > Al
7. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
AlF3 + 3NH4OH → Al(OH)3↓ + 3NH4F
2AlBr3 + 3H2SO4 → Al2(SO4)3 + 6HBr
NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
NaAlO2 + HCl + H2O → Al(OH)3↓ + NaCl