Tailieumoi.vn xin giới thiệu phương trình 2Al2O3 + 3C + N2 → 2AlN + 3CO↑ gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Nhôm. Mời các bạn đón xem:
Phương trình 2Al2O3 + 3C + N2 → 2AlN + 3CO↑
1. Phương trình phản ứng hóa học:
2Al2O3 + 3C + N2 → 2AlN + 3CO↑
2. Hiện tượng nhận biết phản ứng
- Xuất hiện khí CO thoát ra khỏi dung dịch
3. Điều kiện phản ứng
- Nhiệt độ: 1600 - 1800oC
4. Tính chất hoá học
a. Tính chất hoá học của Al2O3
- Al2O3 là oxit lưỡng tính.
+ Tác dụng với axit:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
+ Tác dụng với dung dịch bazơ mạnh
Al2O3 + 2NaOH → NaAlO2 + H2O
hay
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2OH- → 2AlO2- + H2O
- Al2O3 tác dụng với C
Al2O3 + 9C 
b. Tính chất hoá học của Cacbon
- Trong các dạng tồn tại của C, C vô định hình hoạt động hơn cả về mặt hóa học.
- Trong các phản ứng hóa học C thể hiện hai tính chất: Tính oxi hóa và tính khử. Tuy nhiên tính khử vẫn là chủ yếu của C.
Tính khử
- Tác dụng với oxi
Ở nhiệt độ cao C lại khử CO2 theo phản ứng:
- Tác dụng với oxit kim loại:
+ C khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
CuO + C → Cu + CO (tº)
Fe2O3 + 3C → 2Fe + 3CO (tº)
+ Với CaO và Al2O3:
CaO + 3C → CaC2 + CO (trong lò điện)
2Al2O3 + 9C → Al4C3 + 6CO (2000ºC)
- Tác dụng với các chất oxi hóa mạnh thường gặp H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7, ... trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2).
C + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O (tº)
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O (tº)
C + 4KNO3 → 2K2O + CO2 + 4NO2 (tº)
- Khi nhiệt độ cao, C tác dụng được với hơi nước:
C + H2O → CO + H2 (1000ºC)
C + 2H2O → CO2 + 2H2
Tính oxi hóa
- Tác dụng với hidro
- Tác dụng với kim loại
c. Tính chất hoá học của N2
- Nitơ có các số oxi hoá: -3, 0, +1, +2, +3, +4, +5.
- N2 có số oxi hoá 0 nên vừa thể hiện tính oxi hoá và tính khử.
- Nitơ có EN N = 946 kJ/mol, ở nhiệt độ thường nitơ khá trơ về mặt hóa học nhưng ở nhiệt độ cao hoạt động hơn.
- Nitơ thể hiện tính oxi hóa và tính khử, tính oxi hóa đặc trưng hơn.
Tính oxi hoá: Phân tử nitơ có liên kết ba rất bền, nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường.
Tác dụng với hidro
Ở nhiệt độ cao, áp suất cao và có xúc tác. Nitơ phản ứng với hidro tạo amoniac.
Tác dụng với kim loại
- Ở nhiệt độ thường nitơ chỉ tác dụng với liti tạo liti nitrua: 6Li + N2 → 2Li3N.
- Ở nhiệt độ cao, nitơ tác dụng với nhiều kim loại: 3Mg + N2 → Mg3N2 (magie nitrua).
Lưu ý: Các nitrua dễ bị thủy phân tạo NH3.
Nitơ thể hiện tính oxi hoá khi tác dụng với nguyên tố có độ âm điện nhỏ hơn.
Tính khử
- Ở nhiệt độ cao (3000 ºC) Nitơ phản ứng với oxi tạo nitơ monoxit.
- Ở điều kiện thường, nitơ monoxit tác dụng với oxi không khí tạo nitơ đioxit màu nâu đỏ.
Nitơ thể hiện tính khử khi tác dụng với nguyên tố có độ âm điện lớn hơn.
- Các oxit khác của nitơ: N2O, N2O3, N2O5 không điều chế được trực tiếp từ nitơ và oxi.
Ghi nhớ: Nitơ thể hiện tính khử khi tác dụng với các nguyên tố có độ âm điện lớn hơn. Thể hiện tính oxi hóa khi tác dụng với các nguyên tố có độ âm điện lớn hơn.
5. Cách thực hiện phản ứng
- Cho Al2O3 tác dụng với than cốc và khí N2
6. Bài tập liên quan
Ví dụ 1: Cho dd NH3 dư vào dd AlCl3 và ZnCl2 thu được A. Nung A được chất rắn B. Cho luồng H2 đi qua B nung nóng sẽ thu được chất rắn:
A. Zn và Al
B. Zn và Al2O3
C. ZnO và Al2O3
D. Al2O3
Đáp án: D
Hướng dẫn giải
Cho NH3 dư vào thì kết tủa thu được chỉ có Al(OH)3, nung nóng X thì thu được Y sẽ là Al2O3. CO không có phản ứng với Al2O3 nên chất rắn thu được là Al2O3.
Ví dụ 2: Trong các kim loại sau: Cu, Fe, Pb, Al người ta thường dùng kim loại nào để làm vật liệu dẫn điện hay dẫn nhiệt.
A. Chỉ có Cu
B. Cu và Al
C. Fe và Al
D. Chỉ có Al
Đáp án: B
Hướng dẫn giải
Đồng và nhôm được dùng làm vật liệu dẫn nhiệt
Ví dụ 3: Kim loại nào sau đây được dùng nhiều nhất để đóng gói thực phẩm:
A. Zn
B. Fe
C. Sn
D. Al
Đáp án: D
Hướng dẫn giải
Nhôm được sử dụng để đóng gói thực phẩm
7. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
Al2O3 + 6NaOH + 12HF → 9H2O + 2Na3AlF6
Phản ứng nhiệt phân: 2Al(OH)3 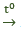
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O
Al(OH)3 + NaOH → 2H2O + NaAlO2