Với Giải hóa học lớp 10 trang 57 Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 57 Cánh diều
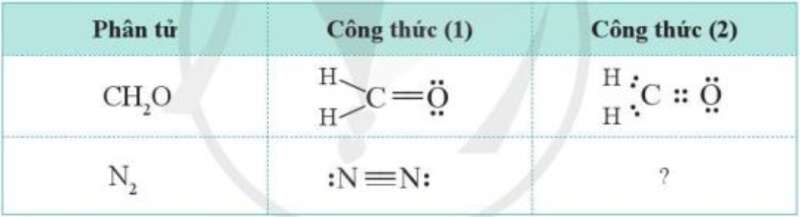
Mở đầu trang 57 Hóa học 10: Công thức của CH2O có thể biểu diễn ở dạng công thức (1) hoặc ở dạng công thức (2). Hãy viết công thức của N2 theo cách (2) và cho biết công thức này có thể hiện được quy tắc octet hay không?
Phương pháp giải:
- Viết công thức của N2 theo cách (2): 2 nguyên tử N liên kết với nhau bằng 1 nối ba
⟹ Số cặp electron dùng chung
⟹ Công thức của N2 theo cách (2).
- Từ số cặp electron dùng chung ⟹ Kết luận công thức có thể hiện được quy tắc octet không.
Lời giải:
- 2 nguyên tử N liên kết với nhau bằng 1 nối ba.
⟹ Có 3 cặp electron dùng chung
⟹ Công thức của N2 theo cách (2):
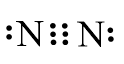
- Mỗi nguyên tử N cùng góp chung 3e để đạt cấu hình electron khí hiếm bền vững.
⟹ Công thức (2) thể hiện được quy tắc octet.
Câu hỏi 1 trang 57 Hóa học 10: Mỗi nguyên tử trong phân tử HF (Hình 11.1) có bao nhiêu electron chung, bao nhiêu electron hóa trị riêng (electron thuộc về một nguyên tử).
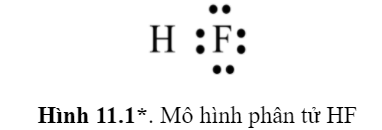
Phương pháp giải:
- Electron dùng chung là số electron các nguyên tử góp chung để đạt cấu hình electron bền vững.
- Electron hóa trị riêng (electron thuộc về một nguyên tử) là hóa trị cao nhất của nguyên tử.
Lời giải:
- Nguyên tố H và F sẽ góp chung 1 electron để đạt cấu hình electron bền vững.
⟹ Số electron chung là: 2
- H có hóa trị cao nhất là I ⟹ Electron hóa trị riêng của H là 1.
- F có hóa trị cao nhất là IIV ⟹ Electron hóa trị riêng của F là 7.
Xem thêm các bài giải Hóa học lớp 10 Cánh diều tạo hay, chi tiết khác: