Với Giải hóa học lớp 10 trang 58 Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 58 Cánh diều
Câu hỏi 2 trang 58 Hóa học 10: Trong phân tử HCl, lớp electron ngoài cùng của Cl và H lần lượt có bao nhiêu electron?
Phương pháp giải:
Dựa vào cấu hình electron lớp ngoài cùng của Cl và H ⟹ Tính số electron.
Lời giải:
- Cấu hình electron của H: 1s1 ⟹ Có 1 electron ở lớp ngoài cùng.
- Cấu hình electron của Cl: [Ne]3s23p5 ⟹ Có 7 electron ở lớp ngoài cùng.
Câu hỏi 3 trang 58 Hóa học 10: Nguyên tử fluorine (F) có cấu hình electron là [He]2s22p5. Khi các nguyên tử F liên kết với nhau, để thỏa mãn quy tắc octet, một bạn học sinh đề xuất như sau: Một nguyên tử F nhường 7 electron, tạo ion F7+ có cấu hình là [He]; 7 nguyên tử F khác, mỗi nguyên tử nhận 1 electron tạo 7 ion F- có cấu hình [Ne]. Sau đó 8 ion này hút nhau tạo thành chất có công thức (F7+)(F-)7. Vì sao đề xuất này không hợp lí trong thực tế? Hãy mô tả sự hình thành liên kết trong phân tử F2.
Phương pháp giải:
- Giải thích đề xuất của bạn học sinh không hợp lí trong thực tế: dựa vào độ âm điện, khả năng nhường và nhận electron để đạt cấu hình khí hiếm bền vững và liên kết hình thành giữa 2 nguyên tử F.
- Mô tả sự hình thành liên kết trong phân tử F2 từ 2 nguyên tử F: dựa vào quy tắt octet để đạt được cấu hình của khí hiếm gần nhất.
Lời giải:
- Cấu hình electron của F (Z = 9): 1s22s22p5
- Đề xuất của bạn học sinh không hợp lí trong thực tế vì:
+ Fluorine là nguyên tử có độ âm điện lớn nên khả năng nhận 1 electron dễ hơn nhường 7 electron.
+ Hai nlguyên tử F có độ âm điện bằng nhau nên không hình thành được liên kết ion như công thức (F7+)(F-)7 mà chỉ tạo được liên kết cộng hóa trị không cực.
- Sự hình thành liên kết trong phân tử F2:
Để đạt cấu hình của khí hiếm gần nhất, mỗi nguyên tử F đều cần thêm 1 electron. Vì vậy mỗi nguyên tử N cùng góp 1 electron để tạo nên 1 cặp electron chung cho 2 nguyên tử N.
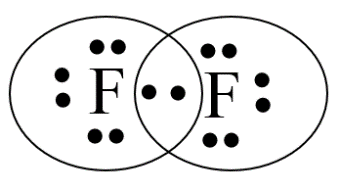
⟹ Hai nguyên tử F liên kết với nhau bằng liên kết cộng hóa trị không cực tạo phân tử F2:
F - F
Luyện tập 1 trang 58 Hóa học 10: Hãy biểu diễn sự hình thành các cặp electron chung cho phân tử NH3. Từ đó, viết công thức Lewis của phân tử này.
Phương pháp giải:
Bước 1: Viết cấu hình electron của N (Z = 7) và H (Z = 1)
Bước 2: Biểu diễn sự hình thành các cặp electron chung cho NH3
Dựa vào cấu hình electron lớp ngoài cùng, biểu diễn sự hình thành các cặp electron chung cho phân tử NH3 theo quy tắc octet.
Bước 3: Công thức Lewis của NH3
- Công thức Lewis là công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp e dùng chung) và các electron riêng.
- Giữa 2 nguyên tử có:
+ 1 cặp e dùng chung: biểu diễn liên kết bằng 1 nối đơn –
+ 2 cặp e dùng chung: biểu diễn bằng 1 nối đôi = hay liên kết đôi
+ 3 cặp e dùng chung: biểu diễn bằng 1 nối hay liên kết ba
Lời giải:
Bước 1: Viết cấu hình electron của N (Z = 7) và H (Z = 1)
N (Z = 7): 1s22s22p3
H (Z = 1): 1s1
Bước 2: Biểu diễn sự hình thành các cặp electron chung cho NH3
H có 1e ở lớp electron ngoài cùng, N có 5e ở lớp electron ngoài cùng.
⟹ Mỗi nguyên tử góp chung 1e để đạt cấu hình khí hiếm bền vững.
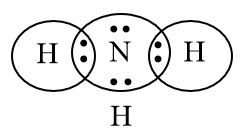
Bước 3: Công thức Lewis của NH3
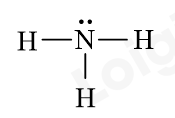
Câu hỏi 4 trang 58 Hóa học 10: Viết công thức Lewis của CO2. Giữa nguyên tử carbon và mỗi nguyên tử oxygen có bao nhiêu cặp electron chung?
Phương pháp giải:
- Xác định số cặp electron dùng chung giữa hai nguyên tử trong CO2.
- Viết công thức Lewis của CO2:
Giữa 2 nguyên tử có:
+ 1 cặp e dùng chung: biểu diễn liên kết bằng 1 nối đơn –
+ 2 cặp e dùng chung: biểu diễn bằng 1 nối đôi = hay liên kết đôi
+ 3 cặp e dùng chung: biểu diễn bằng 1 nối hay liên kết ba
Lời giải:
- Từ công thức electron của CO2:
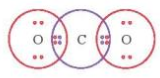
⟹ Mỗi nguyên tử O có 2 cặp electron dùng chung với nguyên tử C.
- Viết công thức Lewis của CO2: O = C = O
Xem thêm các bài giải Hóa học lớp 10 Cánh diều tạo hay, chi tiết khác: