Với Giải hóa học lớp 10 trang 63 Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 63 Cánh diều
Bài 1 trang 63 Hóa học 10: Những phát biểu nào sau đây đúng?
(a) Nếu cặp electron chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị không cực.
(b) Nếu cặp electron chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị có cực.
(c) Cặp electron chung luôn được tạo nên từ 2 electron của cùng một nguyên tử.
(d) Cặp electron chung được tạo nên từ 2 electron hóa trị.
Phương pháp giải:
Dựa vào lý thuyết liên kết cộng hóa trị.
Lời giải:
(a) Sai, nếu cặp electron chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị có cực.
(b) Đúng.
(c) Sai, cặp electron chung được tạo nên từ 2 electron của 2 nguyên tử.
(d) Đúng, cặp electron chung được tạo nên từ 2 electron hóa trị (electron ngoài cùng là những electron ở các orbital ngoài cùng và có thể tham gia vào các liên kết của nguyên tử).
Bài 2 trang 63 Hóa học 10: Những phát biểu nào sau đây đúng?
(a) Liên kết đôi được tạo nên từ 2 liên kết .
(b) Liên kết ba được tạo nên từ 2 liên kết và 1 liên kết .
(c) Liên kết đôi được tạo nên từ 1 liên kết và 1 liên kết .
(d) Liên kết đôi được tạo nên từ 1 liên kết và 2 liên kết .
Phương pháp giải:
Dựa vào lý thuyết liên kết sigma và liên kết pi.
Lời giải:
(a) Sai, liên kết đôi được tạo nên từ 1 liên kết và 1 liên kết .
(b) Sai, liên kết ba được tạo nên từ 1 liên kết và 2 liên kết .
(c) Đúng.
(d) Sai.
Bài 3 trang 63 Hóa học 10: Viết công thức Lewis cho các phân tử H2O và CH4. Mỗi phân tử này có bao nhiêu cặp electron hóa trị riêng?
Phương pháp giải:
- Viết CT electron của phân tử H2O và CH4.
- Từ CT electron viết CT Lewis, xác định số cặp electron hóa trị riêng.
Lời giải:
- Phân tử H2O:
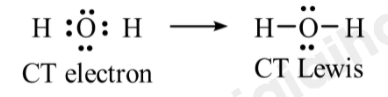
⟹ Phân tử H2O có 2 cặp electron hóa trị riêng.
- Phân tử CH4:
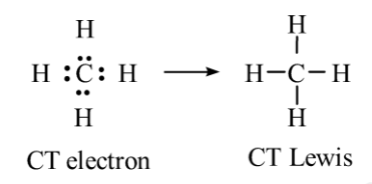
⟹ Phân tử CH4 không có cặp electron hóa trị riêng.
Bài 4 trang 63 Hóa học 10: Sử dụng bảng giá trị năng lượng liên kết ở Phụ lục 2.
a) Hãy tính tổng năng lượng liên kết trong mỗi phân tử H2S và H2O.
b) Nhiệt độ để bắt đầu phá vỡ liên kết (nhiệt độ phân hủy) trong hai chất trên ứng với một trong hai nhiệt độ sau: 400oC hoặc 1000oC. Em hãy dự đoán nhiệt độ phân hủy của chất nào cao hơn. Vì sao?
Phương pháp giải:
a)
- Xem năng lượng liên kết của một số loại liên kết (kJ mol-1), xác định năng lượng liên kết của S – H, O – H.
- Tính tổng năng lượng liên kết trong mỗi phân tử H2S và H2O.
b) Năng lượng liên kết càng lớn, liên kết đó càng bền.
⟹ Nhiệt độ phân hủy càng lớn.
⟹ Dự đoán nhiệt độ phân hủy của chất nào cao hơn.
Lời giải:
a)
- Phân tử H2S:
+ Năng lượng liên kết của S – H là: 368 kJ mol-1.
+ Vì có 2 liên kết S – H
⟹ Tổng năng lượng liên kết trong phân tử H2S là: 368.2 = 736 (kJ mol-1)
- Phân tử H2O:
+ Năng lượng liên kết của O – H là: 464 kJ mol-1.
+ Vì có 2 liên kết O – H
⟹ Tổng năng lượng liên kết trong phân tử H2O là: 464.2 = 928 (kJ mol-1)
b)
- Ta thấy năng lượng liên kết của H2S là 38 kJ mol-1 ; của H2O là 928 kJ mol-1.
⟹ Năng lượng liên kết của H2S < H2O.
⟹ Liên kết của H2O bền hơn H2S.
⟹ Nhiệt độ phân hủy của H2O > H2S.
Bài 5 trang 63 Hóa học 10: Khi phản ứng với H2, các phân tử như F2, N2 cần phải cắt đứt liên kết giữa các nguyên tử. Dựa vào năng lượng liên kết, em hãy dự đoán phản ứng của F2 hay của N2 với H2 sẽ thuận lợi hơn (dễ xảy ra hơn)?
Phương pháp giải:
- Xem giá trị năng lượng liên kết của F – F trong phân tử F2 và năng lượng liên kết của N = N trong phân tử N2.
- So sánh 2 giá trị năng lượng này, nếu giá trị liên kết thấp hơn thì liên kết dễ bị phá vỡ.
⟹ Phản ứng với H2 sẽ thuận lợi hơn (dễ xảy ra hơn).
Lời giải:
- Giá trị năng lượng liên kết của:
+ F – F trong phân tử F2: 159 kJ mol-1
+ N = N trong phân tử N2: 418 kJ mol-1
⟹ Năng lượng liên kết của F – F < N = N.
⟹ Liên kết của N2 bền hơn F2.
- Vậy phản ứng giữa F2 với H2 thuận lợi hơn (dễ xảy ra hơn) so với phản ứng giữa N2 với H2.
Xem thêm các bài giải Hóa học lớp 10 Cánh diều tạo hay, chi tiết khác: