Với Giải hóa học lớp 10 trang 59 Chân trời sáng tạo chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 59 Chân trời sáng tạo
 Lời giải:
Lời giải:
Liên kết mà các nguyên tử sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet được gọi là liên kết cộng hóa trị
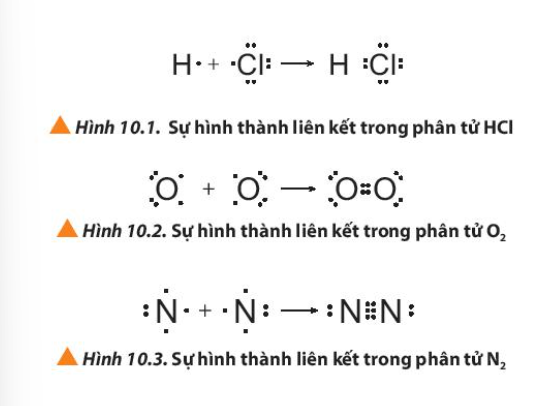
Câu hỏi 1 trang 59 Hóa học 10: Quan sát các Hình 10.1 đến 10.3, cho biết quy tắc octet đã được áp dụng ra sao khi các nguyên tử tham gia hình thành liên kết.
Phương pháp giải:
Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung
Lời giải:
Nguyên tử bị thiếu bao nhiêu electron thì bỏ ra bấy nhiêu electron để góp chung electron với các nguyên tử khác => Đạt cấu hình eleectron bền vững của khí hiếm
Ví dụ:
- Nguyên tử O cần nhận thêm 2 electron => Bỏ ra 2 electron để góp chung
- Nguyên tử Cl và H cần nhận thêm 1 electron => Mỗi nguyên tử bỏ ra 1 electron để góp chung
- Nguyên tử N cần nhận thêm 3 electron => Bỏ ra 3 electron để góp chung
Câu hỏi 2 trang 59 Hóa học 10: Giải thích sự hình thành liên kết trong các phân tử HCl, O2 và N2
Phương pháp giải:
Các nguyên tử sẽ góp 1 hay nhiều electron để hình thành 1 hay nhiều cặp electron chung => Thỏa mãn quy tắc octet
Lời giải chi tiết:
- Xét phân tử HCl:
+ Nguyên tử H có 1 electron ở lớp ngoài cùng, có xu hướng nhận thêm 1 electron
+ Nguyên tử Cl có 7 electron ở lớp ngoài cùng, có xu hướng nhận thêm 1 electron
=> Nguyên tử H và Cl sẽ góp 1 electron tạo thành 1 cặp electron chung
- Xét phân tử O2:
+ Nguyên tử O có 6 electron ở lớp ngoài cùng, có xu hướng nhận thêm 2 electron
=> Mỗi nguyên tử O sẽ góp 2 electron tạo thành 2 cặp electron chung
- Xét phân tử N2:
+ Nguyên tử N có 5 electron ở lớp ngoài cùng, có xu hướng nhận thêm 3 electron
=> Mỗi nguyên tử N sẽ góp 3 electron tạo thành 3 cặp electron chung
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác: