Với Giải hóa học lớp 10 trang 66 Chân trời sáng tạo chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 66 Chân trời sáng tạo
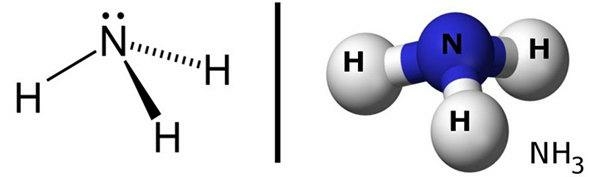
Câu hỏi 20 trang 66 Hóa học 10: Trình bày các bước trong quá trình lắp ráp mô hình phân tử NH3
Phương pháp giải:
Bước 1: Xác định hình học phân tử cần lắp ráp
Bước 2: Xác định số lượng các loại liên kết và kiểu liên kết
Bước 3: Hoàn chỉnh mô hình phân tử
Lời giải:
Bước 1: Hình học phân tử của NH3: tứ diện đều, mỗi nguyên tử nằm ở 1 đỉnh của tứ diện
Bước 2: Phân tử NH3: gồm 3 quả cầu H và 1 quả cầu N, 3 thanh nối tương ứng với 3 liên kết đơn giữa N và H
Bước 3: Hoàn chỉnh mô hình phân tử.
Câu hỏi 21 trang 66 Hóa học 10: Mô hình sau biểu diễn phân tử CH4 hay phân tử CH3Cl?

Phương pháp giải:
- Mô hình có 3 nguyên tố tương ứng với 3 màu của quả cầu: trắng, đen, xanh
Lời giải:
- Phân tử CH4 được tạo bởi 2 nguyên tố: C và H
- Phân tử CH3Cl được tạo bởi 3 nguyên tố: C, H và Cl
=> Mô hình trên biểu diễn phân tử của CH3Cl
Vận dụng trang 66 Hóa học 10: Lắp ráp mô hình phân tử C2H2, biết toàn bộ các nguyên tử nằm trên cùng một đường thẳng.
Phương pháp giải:
- Mô hình C2H2 có 1 liên kết 3 giữa 2 nguyên tử C
- Mỗi 1 C liên kết với 1 H bằng liên kết đơn
Lời giải:

Bài 1 trang 66 Hóa học 10: Trong phân tử iodine (I2), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron chung. Nhờ đó, mỗi nguyên tử iodine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe
B. Ne
C. Ar
D. Kr
Phương pháp giải:
I nằm ở vị trí nhóm VIIA, chu kì 5
Lời giải:
- Trong bảng tuần hoàn, I nằm ở nhóm VIIA, chu kì 5
=> Có 7 electron ở lớp vỏ ngoài cùng và có 5 lớp electron
- Khi góp dùng chung 1 cặp electron => I có 8 electron ở lớp vỏ ngoài cùng và có 5 lớp electron
=> Giống cấu hình electron của khí hiếm Xe
Đáp án A
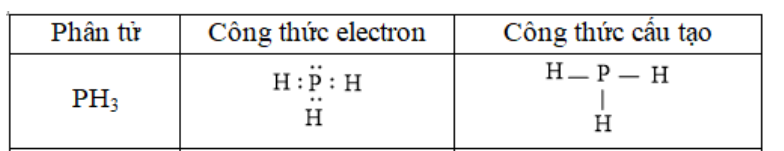
Bài 2 trang 66 Hóa học 10: Hydrogen sulfide (H2S) và phosphine (PH3) đều là những chất có mùi khó ngửi và rất độc. Trình bày sự tạo thành liên kết cộng hóa trị trong phân tử các chất trên.
Phương pháp giải:
- Xét phân tử H2S được tạo từ 2 phi kim
+ S có 6 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 2 electron
+ H có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 1 electron
- Xét phân tử PH3 được tạo từ 2 phi kim
+ P có 5 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 3 electron
+ H có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 1 electron
Lời giải:
- Xét phân tử H2S được tạo từ 2 phi kim
+ S có 6 electron ở lớp ngoài cùng
+ H có 1 eelctron ở lớp ngoài cùng
=> Nguyên tử H cần thêm 1 electron và S cần thêm 2 electron để đạt cấu hình electron bền vững của khí hiếm
=> Khi 2 nguyên tử H và 1 nguyên tử S liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử S góp ra 2 electron để tạo ra 2 đôi electron dùng chung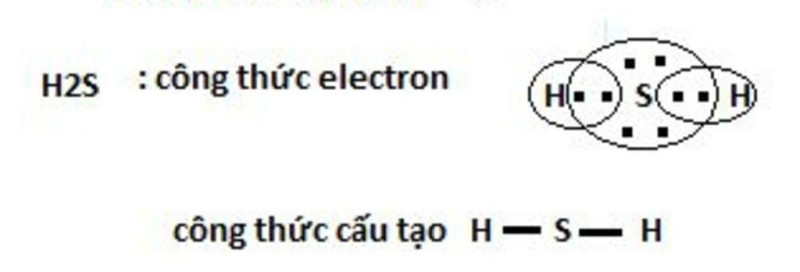
- Xét phân tử PH3 được tạo từ 2 phi kim
+ P có 5 electron ở lớp ngoài cùng
+ H có 1 elctron ở lớp ngoài cùng
=> Nguyên tử H cần thêm 1 electron và P cần thêm 3 electron để đạt cấu hình electron bền vững của khí hiếm
=> Khi 3 nguyên tử H và 1 nguyên tử P liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử P góp ra 3 electron để tạo ra 3 đôi electron dùng chung
Bài 3 trang 66 Hóa học 10: Viết công thức Lewis của các phân tử CS2, SCl2 và CCl4
Phương pháp giải:
- Nguyên tử C bỏ ra 4 electron để góp chung
- Nguyên tử S bỏ ra 2 electron để góp chung
- Nguyên tử Cl bỏ ra 1 electron để góp chung
Lời giải:
- Phân tử CS2: Mỗi nguyên tử S sẽ góp 2 electron và nguyên tử C góp 4 electron để tạo thành 4 cặp electron dùng chung
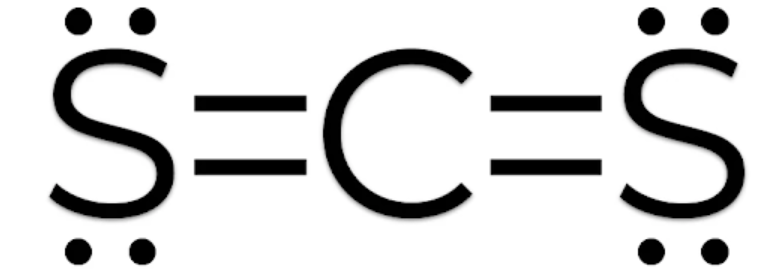
- Phân tử SCl2: Mỗi nguyên tử Cl sẽ góp 1 electron và nguyên tử S góp 2 electron để tạo thành 2 cặp electron dùng chung
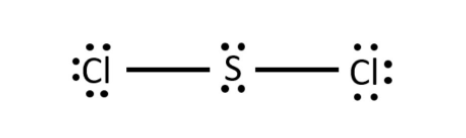
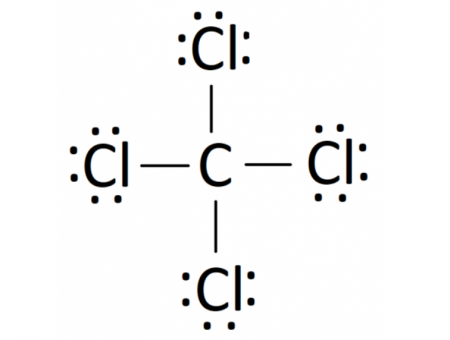
- Phân tử CCl4: Mỗi nguyên tử Cl sẽ góp 1 electron và nguyên tử C góp 4 electron để tạo thành 4 cặp electron dùng chung
Bài 4 trang 66 Hóa học 10: Trình bày sự hình thành liên kết cho – nhận trong phân tử sulfur dioxide (SO2)
Phương pháp giải:
- O cần nhận thêm 2 electron
- S cần nhận thêm 2 electron
Lời giải:
- O có 6 electron ở lớp ngoài cùng => Cần nhận thêm 2 electron
- S có 6 elctron ở lớp ngoài cùng => Cần nhận thêm 2 electron
=> 1 nguyên tử S sẽ liên kết với 1 nguyên tử O bằng cách góp chung 2 electron
- Khi đó nguyên tử S có 8 electron, O có 8 electron ở lớp ngoài cùng => Còn 1 O chưa tham gia liên kết
- Trong khi đó nguyên tử S vẫn còn 2 đôi electron chưa tham gia liên kết
=> Nguyên tử S sẽ cho nguyên tử O chưa tham gia liên kết 1 cặp electron để dùng chung
=> Công thức electron và công thức cấu tạo:
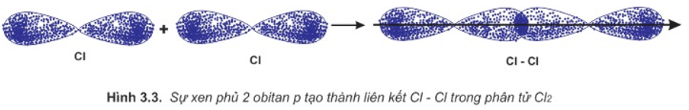
Bài 5 trang 66 Hóa học 10: Mô tả sự tạo thành liên kết trong phân tử chlorine bằng sự xen phủ của các AO
Phương pháp giải:
Sự hình thành liên kết giữa hai nguyên tử chlorine là do sự xen phủ giữa hai obitan p chứa electron độc thân của mỗi nguyên tử chlorine
Lời giải:
Để giải thích sự hình thành liên kết Cl−Cl, có thể dựa vào cấu hình electron của mỗi nguyên tử clo:
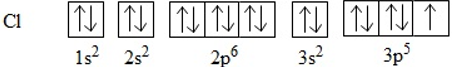
Sự hình thành liên kết giữa hai nguyên tử chlorine là do sự xen phủ giữa hai obitan p chứa electron độc thân của mỗi nguyên tử chlorine
Bài 6 trang 66 Hóa học 10: Sự xen phủ giữa hai orbital p trong trường hợp nào sẽ tạo thành liên kết σ? Trong trường hợp nào sẽ tạo thành liên kết п? Cho ví dụ.
Phương pháp giải:
- Liên kết σ là sự xen phủ trục
- Liên kết п là sự xen phủ bên
Lời giải:
Khi các nguyên tử liên kết với nhau, các AO phải được sắp xếp ở vị trí phù hợp. Chẳng hạn khi hình thành phân tử giữa hai nguyên tử, vị trí của các AO như sau:
- Hai AO pz nằm dọc trên cùng một trục nên chỉ có thể xen phủ trục với nhau ⇒ Chỉ tạo thành liên kết σ.
- Hai AO px hoặc hai AO py là song song nên chỉ có thể xen phủ bên với nhau ⇒ Tạo thành liên kết π.
Bài 7 trang 66 Hóa học 10: Cho biết số liên kết σ và liên kết п trong phân tử acetylene (C2H2).
Phương pháp giải:
- Phân tử C2H2 gồm có liên kết 3 giữa 2 nguyên tử C, các liên kết đơn giữa nguyên tử C và H
Lời giải:
- Phân tử C2H2 gồm có liên kết 3 giữa 2 nguyên tử C, các liên kết đơn giữa nguyên tử C và H
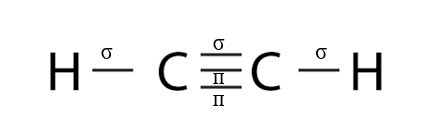
=> Có 2 liên kết п và 3 liên kết σ
Bài 8 trang 66 Hóa học 10: Năng lượng liên kết của các hydrogen halide được liệt kê trong bảng sau:
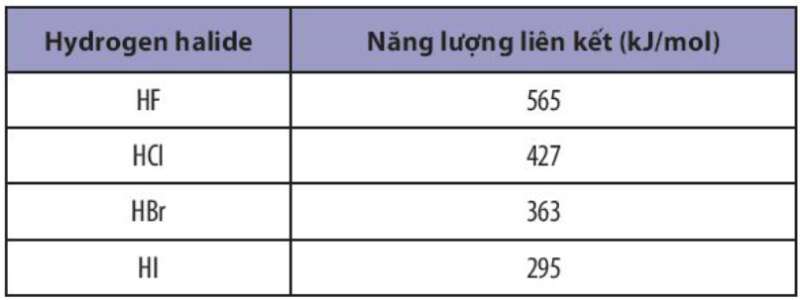 Sắp xếp theo chiều tăng dần độ bền liên kết trong các phân tử HF, HCl, HBr và HI
Sắp xếp theo chiều tăng dần độ bền liên kết trong các phân tử HF, HCl, HBr và HI
Phương pháp giải:
HX nào có năng lượng liên kết càng lớn thì độ bền liên kết càng cao
Lời giải:
- Sắp xếp theo chiều tăng dần giá trị năng lượng liên kết: HI < HBr < HCl < HF
=> Sắp xếp theo chiều tăng dần độ bền liên kết: HI < HBr < HCl < HF
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác: