Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 11 Bài 10: Photpho chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 10: Photpho
Bài 10.1 trang 16 SBT Hóa học 11: Photpho đỏ và photpho trắng giống nhau ở điểm nào?
Ạ. Chúng đều không tan trong nước nhưng tan được trong benzen.
B. Chúng đều tác dụng dễ dàng với khí clo khi đốt nóng.
C. Chúng đều phát sáng màu lục nhạt trong bóng tối.
D. Chúng đều gây bỏng nặng khi rơi vào da.
Lời giải:
Photpho đỏ và photpho trắng đều tác dụng dễ dàng với khí clo khi đốt nóng.
=> Chọn B
Bài 10.2 trang 17 SBT Hóa học 11: Nhận xét nào dưới đây là đúng?
A. Photpho có tính phi kim mạnh hơn nitơ.
B. Photpho đỏ và photpho trắng hoạt động hóa học mạnh với mức độ như nhau.
C. Ở nhiệt độ thường, photpho hoạt động hóa học tương đối mạnh còn nitơ thì trơ.
D. Photpho đỏ và photpho trắng có cấu tạo phân tử giống nhau.
Lời giải:
Do trong nitơ có chứa liên kết ba nên nitơ trơ về mặt hóa học. Còn photpho hoạt động hóa học tương đối mạnh
=> Chọn C
Bài 10.3 trang 17 SBT Hóa học 11: Hãy chọn nửa câu ở cột (II) ghép với nửa câu ở cột (I) để được câu phù hợp :
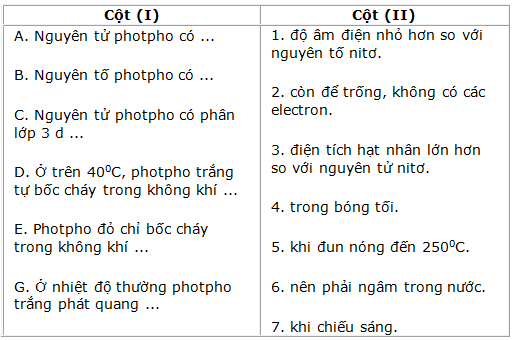
Lời giải:
A - 3; B - 1; C-2; D-6; E-5; G-4.
Bài 10.4 trang 17 SBT Hóa học 11: Đốt cháy hoàn toàn 6,2 g photpho trong oxi lấy dư. Cho sản phẩm tạo thành tác dụng với 150 ml dung dịch NaOH 2M. Sau phản ứng, trong dung dịch thu được có các muối :
A. NaH2PO4 và Na2HPO4
B. Na2HPO4 và Na3PO4
C. NaH2PO4 và Na3PO4
D. Na3PO4.
Phương pháp giải:
PTHH đốt photpho trong oxi lấy dư: 4P+5O2 2P2O5
Tính nP => nP2O5
Xét tỉ lệ số mol NaOH và P2O5 : . Từ đó suy ra muối nào được tạo thành sau phản ứng.
Lời giải:
4P+5O2 2P2O5 (1)
P2O5 + 2NaOH + H2O 2NaH2PO4 (2)
P2O5 + 4NaOH 2Na2HPO4 + H2O (3)
P2O5 + 6NaOH 2Na3PO4 + 3H2O (4)
Số mol photpho : nP = = 0,2 (mol).
Số mol NaOH : nNaOH = = 0,3 (mol)
Sản phẩm tạo thành khi đốt photpho là P2O5.
Theo (1), số mol P2O5 = .nP = =0,1 (mol).
Ti lệ số mol NaOH và P2O5 :
Tỉ lệ số mol nằm trong khoảng 2 và 4, do đó theo các phản ứng (2) và (3) trong dung dịch thu được có hai muối được tạo thành là NaH2PO4 và Na2HPO4.
=> Chọn A
Bài 10.5 trang 17 SBT Hóa học 11: Xác định số oxi hoá của photpho trong các hợp chất và ion sau đây :
.
Lời giải:
Số oxi hoá của photpho trong các hợp chất và ion :
.
Bài 10.6 trang 17 SBT Hóa học 11: Viết các phương trình hóa học thực hiện sơ đồ chuyển hóa sau :
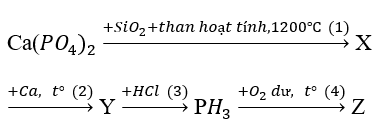
Lời giải:
(1)
X là P
(2)
Y là
(3)
(4)
Z là
Bài 10.7 trang 17 SBT Hóa học 11: Đốt cháy a gam photpho đỏ trong không khí lấy dư, rồi cho sản phẩm thu được vào 500 ml dung dịch 85% (D = 1,7 g/ml). Sau khi phản ứng xảy ra hoàn toàn nồng độ của dung dịch xác định được là 92,6%. Tính giá trị của a.
Phương pháp giải:
+) PTHH: → (1)
(2)
+) Dựa vào PT (1)và (2) ta biểu diễn được khối lượng do P phản ứng tạo ra.
+) Tính khối lượng có trong 500 ml dung dịch 85%.
+) Tính khối lượng chất tan sau khi đã hoà tan P2O5 .
+) Tính khối lượng dung dịch .
+) Áp dụng công thức tính nồng độ phần trăm (C%) ta được phương trình ẩn a.
+) Giải phương trình => a
Lời giải:
Photpho cháy trong không khí lấy dư theo phản ứng :
→ (1)
4 mol (4.31 g) 2 mol (2.142 g)
P2O5 tác dụng với tạo thành theo phản ứng :
(2)
1 mol (142 g) 2 mol (2.98 g)
Theo phản ứng (1) : 4.31 g P tạo ra 2.142 g P2O5
a g P tạo ra (g) P2O5
Theo các phản ứng (1) và (2) :
4.31 (g) P tạo ra 4.98 (g)
a (g) P tạo ra (g)
Khối lượng có trong 500 ml dung dịch 85% :
= 722,5 (g)
Khối lượng sau khi đã hoà tan P2O5 : 722,5 g + 3,16.a g
Khối lượng của dung dịch sau khi đã hoà tan P2O5 :
500.1,7 g + 2,29.a g = 850 g + 2,29.a g
Ta có phương trình về nồng độ phần trăm của dung dịch :
= 92,6%
Giải phương trình được a = 62,16 g photpho.