Tailieumoi.vn giới thiệu Giải bài tập Hóa Học lớp 11 Bài 10: Photpho chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Photpho lớp 11.
Giải bài tập Hóa Học lớp 11 Bài 10: Photpho
Câu hỏi và bài tập (trang 49-50 sgk Hóa học 11)
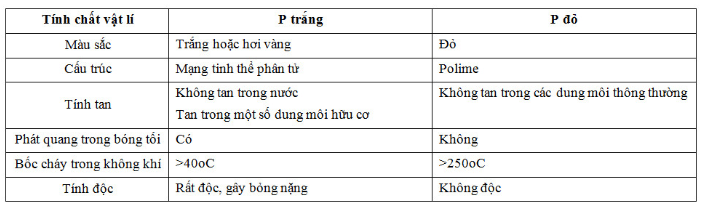
Bài 1 trang 49 sgk hóa học 11: Nêu những điểm khác nhau về tính chất vật lí giữa P trắng và P đỏ. Trong điều kiện nào P trắng chuyển thành P đỏ và ngược lại ?
Lời giải
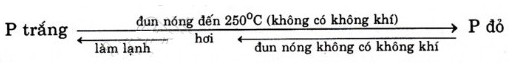
Sự chuyển hóa giữa P trắng và P đỏ:
P + O2 → P2O5
P + Cl2 → PCl3
P + S → P2S3
P + S → P2S5
P + Mg → Mg3P2
P + KClO3 → P2O5 + KCl
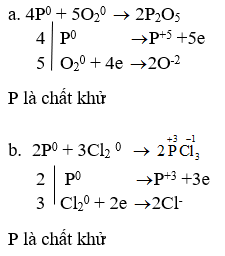
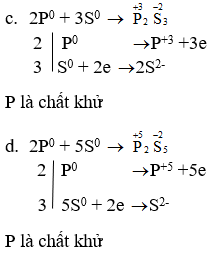
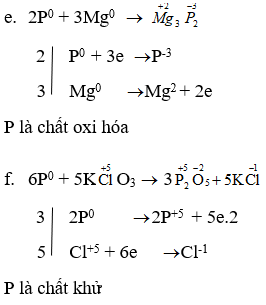
Bài 3 trang 49 sgk hóa học 11: Thí nghiệm ở hình 2.13 chứng minh khả năng bốc cháy khác nhau của P trắng và P đỏ. Hãy quan sát, mô tả và giải thích hiện tượng xảy ra trong thí nghiệm. Viết phương trình hóa học của phản ứng xảy ra.
Hiện tượng: P trắng bốc cháy, còn P đỏ không bốc cháy (hình 2.13, SGK).
Giải thích: Do P trắng có cấu trúc mạng tinh thể phân tử còn P đỏ có cấu trúc polime nên P trắng hoạt động hóa học mạnh hơn P đỏ.
P trắng bốc cháy ở nhiệt độ trên 40oC còn P đỏ chỉ bốc cháy ở nhiệt độ trên 250oC.
P trắng tác dụng với oxi không khí dễ dàng hơn, tạo thành P2O5:
![]()
Bài 4 trang 49 sgk hóa học 11: Nêu những ứng dụng của photpho. Những ứng dụng đó xuất phát từ tính chất gì của photpho ?
* Ứng dụng của photpho:
- Phần lớn photpho sản xuất ra được dùng để sản xuất axit photphoric, phần còn lại chủ yếu dùng trong sản xuất diêm.
- Dùng vào mục đích quân sự: sản xuất bom, đạn cháy, đạn khói, ...
Những ứng dụng này xuất phát từ tính khử hoặc tính oxi hóa của photpho.
Bài 5 trang 49 sgk hóa học 11: Đốt cháy hoàn toàn 6,2 g photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính khối lượng dung dịch NaOH đã dùng.
c) Tính nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng.
Phương pháp giải
- Dựa theo các dữ kiện đề bài để viết các PTHH xảy ra.
- Tính toán theo PTHH.

Lý thuyết Photpho
I. VỊ TRÍ VÀ CẤU HÌNH
- Trong bảng tuần hoàn photpho ở ô thứ 15, nhóm VA, chu kì 3.
- Cấu hình electron lớp ngoài cùng: 1s22s22p63s23p3.
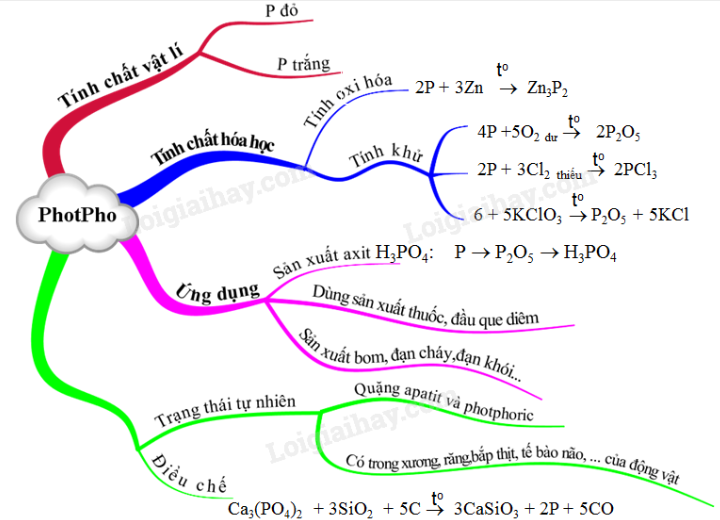
II. TÍNH CHẤT VẬT LÍ
1. Photpho trắng
Chất rắn màu trắng hoặc hơi vàng, rất độc, dễ gây bỏng nặng khi rơi vào da; mềm và dễ nóng chảy; không tan trong nước và dễ tan trong dung môi hữu cơ.
2. Photpho đỏ
- Chất rắn có màu đỏ, không độc, dễ hút ẩm và chảy rữa; không tan trong các dung môi thông thường.
P đỏ (rắn) P đỏ (hơi) → P trắng.
- Hai dạng này khác nhau về tính chất vật lí do chúng khác nhau về cấu trúc tinh thể và khả năng liên kết. Trong hai dạng thù hình photpho trắng hoạt động hơn photpho đỏ.
III. TÍNH CHẤT HÓA HỌC
- Độ âm điện P < N.
- Nhưng P hoạt động hóa học hơn N2 vì liên kết N ≡ N bền vững.
- P trắng hoạt động hơn P đỏ.
1. Tính OXH
- Tác dụng với kim loại hoạt động mạnh:
2. Tính khử:
- Tác dụng với oxi, halogen, lưu huỳnh...
2P + 5Cl2 2PCl5
- Tác dụng với hợp chất:
P + 5HNO3 → H3PO4 + 5NO2 + H2O
IV. TRẠNG THÁI TỰ NHIÊN
Trong tự nhiên photpho nằm ở dạng muối của axit photphoric. Hai khoáng vật chính của photpho là aptit 3Ca3(PO4)2 . CaF2 và photphorit Ca3(PO4)2.
V. ĐIỀU CHẾ
- Trong công nghiệp, photpho được sản xuất bằng cách nung hỗn hợp quặng photphorit, cát và than cốc ở 12000C trong lò điện:
Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 2P + 5CO
- Phần lớn photpho sản xuất ra được dùng để sản xuất axit photphoric, phần còn lại chủ yếu dùng trong sản xuất diêm. Ngoài ra, photpho còn được dùng vào mục đích quân sự: sản xuất bom, đạn cháy, đạn khói,…
Sơ đồ tư duy: Photpho
Phương pháp giải một số dạng bài tập về photpho
Dạng 1: Bài tập lý thuyết về photpho
* Một số lưu ý cần nhớ:
|
- Phopho có 2 dạng thù hình là photpho trắng và phopho đỏ, ở các điều kiện thích hợp, 2 dạng thù hình này có thể chuyển hóa cho nhau - Do liên kết yếu hơn N nên P có mức độ hoạt động hóa học mạnh hơn N, thể hiện tính OXH (tác dụng với KL, lưu ý P không tác dụng với H) thể hiện tính khử khi tác dụng với oxi, clo … - Người ta điều chế photpho bằng cách nung hỗn hợp quặng photphat, SiO2 và C trong lò điện.
|
* Một số ví dụ điển hình:
Ví dụ 1: Cho các phản ứng sau: (1) P + Cl2 (dư, to); (2) P + KClO3 (to); (3) P + H2SO4 (đặc, nóng); (4) P + O2 (thiếu, to). Những trường hợp P bị oxi hóa thành P+5 là
A. (2), (3), (4).
B. (1), (2), (4).
C. (1), (2), (3).
D. (1), (3), (4).
Hướng dẫn giải chi tiết:
(1) 2P + 5Cl2dư → 2PCl5
(2) 6Pđỏ + 3KClO3 3P2O5 + 5KCl (phản ứng xảy ra khi quẹt diêm)
(3) 2P + 5H2SO4 đặc 2H3PO4 + 3H2O + 5SO2
(4) 4P + 3O2 thiếu 2P2O3
Đáp án C
Ví dụ 2: Khi cho P đem trộn với KClO3 nung nóng thu được sản phẩm chứa photpho có công thức là
A. K3P.
B. PCl3.
C. P2O5.
D. K3PO4.
Hướng dẫn giải chi tiết:
PTHH: 6Pđỏ + 3KClO3 3P2O5 + 5KCl (phản ứng xảy ra khi quẹt diêm)
Đáp án C.
Ví dụ 3: Khoáng vật chính của P trong tự nhiên là
A. Apatit 3Ca3(PO4)2.CaF2.
B. Apatit Ca(H2PO4)2.
C. Photphorit Ca3(PO4)2.
D. cả A và C.
Hướng dẫn giải chi tiết:
Khoáng vật chính của P trong tự nhiên là apatit 3Ca3(PO4)2.CaF2 và photphorit Ca3(PO4)2
Đáp án D
Dạng 2: Bài toán về hợp chất của photpho
* Một số ví dụ điển hình
Ví dụ 1: Để trung hoà hoàn toàn dung dịch thu được khi thuỷ phân 4,5375 gam một photpho trihalogenua cần dùng 55 ml dung dịch NaOH 3M. Biết rằng phản ứng thuỷ phân tạo ra hai axit, trong đó có axit H3PO3 là axit hai nấc. Công thức của photpho trihalogenua đó là
Hướng dẫn giải chi tiết:
Gọi x là số mol PX3 phản ứng
Phương trình phản ứng :
PX3 + 3H2O → H3PO3 + 3HX (1)
mol: x → x → 3x
Trung hòa X bằng NaOH => 2 muối thu được là Na2HPO3 và NaX
Bảo toàn nguyên tố P và X: nNa2HPO3 = nH3PO3 = x mol; nNaX = nHX = 3x mol
Bảo toàn nguyên tố Na: nNaOH = 2.nNa2HPO3 + nNaX => 0,165 = 2x + 3x
=> x = 0,033
=> X = 35,5 (Cl)
Ví dụ 2: Đốt cháy hoàn toàn 3,1 gam photpho bằng oxi dư rồi cho sản phẩm tạo thành tác dụng vừa đủ với m gam dung dịch NaOH 32%, thu được muối Na2HPO4. Giá trị của m là :
Hướng dẫn giải chi tiết:
nP = 0,1 mol
Bảo toàn nguyên tố P : nH3PO4 = nNa2HPO4 = nP = 0,1 mol
Bảo toàn nguyên tố Na: nNaOH = 2.nNa2HPO4 = 0,2 mol
=> mdung dịch NaOH = 0,2.40.100 / 32 = 25 gam
Ví dụ 3: Từ quặng photphorit, có thể điều chế axit photphoric theo sơ đồ sau :
Biết hiệu suất chung của quá trình là 90%. Để điều chế được 1 tấn dung dịch H3PO4 49%, cần khối lượng quặng photphorit chứa 73% Ca3(PO4)2 là
Hướng dẫn giải chi tiết:
mH3PO4 = 1.49 / 100 = 0,49 tấn
Ca3(PO4)2 → 2H3PO4
310 196
0,775 tấn ← 0,49 tấn
=> mCa3(PO4)2 thực tế dùng = 0,775.100 / 90 = 31/36 tấn
=> mquặng = 31/36 . 100/73 = 1,18 tấn