Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 9 Bài 9: Tính chất hóa học của muối chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 9. Mời các bạn đón xem:
Giải SBT Hóa học 9 Bài 9: Tính chất hóa học của muối
Bài 9.1 trang 11 SBT Hóa học 9: Thuốc thử dùng để phân biệt hai dung dịch natri sunfat và natri sunfit là
A. dung dịch bari clorua.
B. dung dịch axit clohiđric.
C. dung dịch chì nitrat.
D. dung dịch natri hiđroxit.
Lời giải:
A. BaCl2 + Na2SO3 → 2NaCl + BaSO3 ↓ (trắng)
BaCl2 + Na2SO4 → 2NaCl + BaSO4 ↓ (trắng)
-> Loại
B. 2HCl + Na2SO3 → 2NaCl + SO2↑ + H2O
HCl + Na2SO4 → không phản ứng
C. Pb(NO3)2 + Na2SO3 → 2NaNO3 + PbSO3 ↓ (trắng)
Pb(NO3)2 + Na2SO4 → 2NaNO3 + PbSO4 ↓ (trắng)
-> Loại
D. không xảy ra phản ứng -> Loại
=> Chọn B
Bài 9.2 trang 11 SBT Hóa học 9:
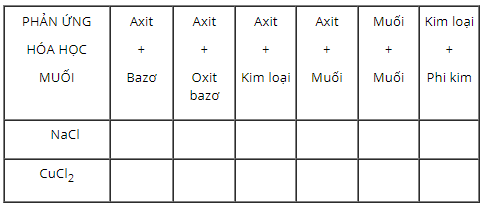
a) Hãy cho biết những phản ứng hoá học nào trong bảng có thể dùng để điều chế các muối sau (Bằng cách ghi dấu x (có) và dấu o (không) vào những ô tương ứng):
Viết các phương trình hoá học.
b) Vì sao có một số phản ứng hoá học trong bảng là không thích hợp cho sự điều chế những muối trên?
Lời giải:
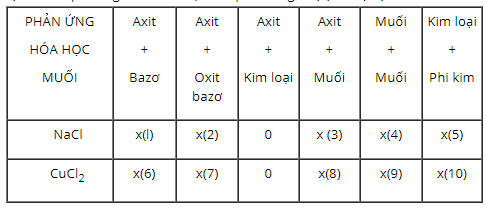
(1) NaOH + HCl → NaCl + H2O
(2) Na2O + 2HCl → 2NaCl + H2O
(3) Na2S + 2HCl → 2NaCl + H2S↑
(4) Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
(5) 2Na + Cl2 → 2NaCl
(6) Cu(OH)2 + 2HCl → CuCl2 + 2H2O
(7) CuO + 2HCl → CuCl2 + H2O
(8) CuCO3 + 2HCl → CuCl2 + H2O + CO2
(9) CuSO4 + BaCl2 → BaSO4↓ + CuCl2
(10) Cu + Cl2 → CuCl2
Một số phản ứng hoá học không thích hợp để điều chế muối NaCl và CuCl2 :
- Kim loại Na có phản ứng với axit HCl tạo muối NaCl. Nhưng người ta không dùng phản ứng này vì phản ứng gây nổ, nguy hiểm.
- Kim loại Cu không tác dụng với axit HCl.
Bài 9.3 trang 11 SBT Hóa học 9: Nếu chỉ dùng dung dịch NaOH thì có thể phân biệt được hai muối trong mỗi cặp chất sau được không?
a) Dung dịch Na2SO4 và dung dịch Fe2(SO4)3.
b) Dung dịch Na2SO4 và dung dịch CuSO4.
c) Dung dịch Na2SO4 và dung dịch BaCl2.
Giải thích và viết phương trình hoá học.
Phương pháp giải:
Xem lại lý thuyết tính chất hóa học của muối, nhận biết các chát dựa trên hiện tượng đặc trưng: kết tủa, khí, màu sắc...
Lời giải:
Dùng dung dịch NaOH có thể phân biệt được 2 muối trong những cặp chất:
a) Dung dịch Na2SO4 và dung dịch Fe2(SO4)3. Dung dịch muối nào tác dụng với dung dịch NaOH tạo ra kết tủa màu đỏ nâu, là muối Fe2(S04)3:
(đỏ nâu)
b) Dung dịch Na2SO4 và dung dịch CuSO4. Dung dịch muối nào tác dụng với dung dịch NaOH tạo ra kết tủa màu xanh, là muối CuSO4 :
(xanh)
c) Dung dịch Na2SO4 và dung dịch BaCl2 : không dùng NaOH để nhận biết 2 dung dịch trên vì sau phản ứng các cặp chất không tồn tại.
Bài 9.4 trang 11 SBT Hóa học 9: Có thể dùng những phản ứng hoá học nào để chứng minh rằng thành phần của muối đồng(II) sunfat có nguyên tố đồng và gốc sunfat?
Phương pháp giải:
Có thể dựa vào màu sắc của một số kết tủa đặc trưng với đồng như Cu(OH)2: xanh lam, Cu: đỏ... còn gốc sunfat nhận biết bằng màu trắng đặc trưng của BaSO4.
Lời giải:
Chọn những thuốc thử để nhận biết trong thành phần của muối đổng(II) suníat có chứa nguyên tố đồng và gốc sunfat :
- Nhận biết nguyên tố đồng. Dùng thuốc thử là kim loại hoạt động, thí dụ Fe, Zn…
Fe + CuSO4 —----> FeSO4 + Cu
(đỏ)
- Nhận biết gốc sunfat : Dùng thuốc thử là dung dịch muối bari, như BaCl2, Ba(NO3)2, Ba(OH)2 :
BaCl2 + CuSO4 —------> CuCl2 + BaSO4
(trắng)
Bài 9.5 trang 12 SBT Hóa học 9: Có những muối sau: CaCO3, CuSO4, MgCl2 .Hãy cho biết muối nào có thể điều chế bằng phương pháp sau :
a) Axit tác dụng với bazơ.
b) Axit tác dụng với kim loại.
c) Muối tác dụng với muối.
d) Oxit bazơ tác dụng với oxit axit.
Viết các phương trình hoá học.
Phương pháp giải:
Xem lại tính chất hóa học của một số hợp chất vô cơ đã học để điều chế muối (sản phẩm có chứa muối cần tìm).
Lời giải:
a) Axit tác dụng với bazơ : CaCO3, CuSO4, MgCl2.
b) Axit tác dụng với kim loại : MgCl2, CuSO4 (dùng H2SO4 đặc).
c) Muối tác dụng với muối : CaCO3, CuSO4, MgCl2. Thí dụ :
CaCl2 + Na2CO3 —------> CaCO3 + 2NaCl
CuCl2 + Ag2SO4 —--------> CuSO4 + 2AgCl
BaCl2 + MgSO4 —-------> BaSO4 + MgCI2
d) Oxit bazơ tác dụng với oxit axit: CaCO3.