Với giải Câu hỏi 9 trang 99 Hóa học lớp 10 Kết nối tri thức với cuộc sống chi tiết trong Bài 19: Tốc độ phản ứng giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 19: Tốc độ phản ứng
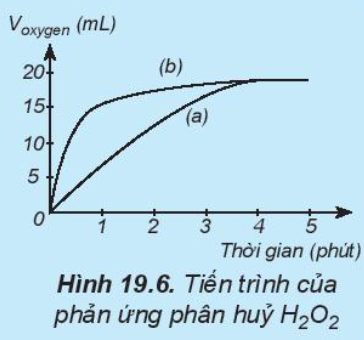
Câu hỏi 9 trang 99 Hóa học 10: Thực hiện hai phản ứng phân hủy H2O2; một phản ứng có xúc tác MnO2, một phản ứng không xúc tác. Đo thể tích khí oxygen theo thời gian và biểu diễn trên đồ thị như hình bên: Đường phản ứng nào trê đồ thị (Hình19.6) tương ứng với phản ứng có xúc tác, với phản ứng không có xúc tác.
Phương pháp giải:
Khi có chất xúc tác, phản ứng sẽ xảy ra qua nhiều giai đoạn. Mỗi giai đoạn đều có năng lượng hoạt hóa thấp hơn so với phản ứng không xúc tác. Do đó số hạt có đủ năng lượng hoạt hóa sẽ nhiều hơn, dẫn đến tốc độ phản ứng tăng lên.
Lời giải:
Trong cùng khoảng thời gian, thể tích khí oxygen được biểu diễn theo đường (b) lớn hơn so với đường (a).
=> Đường phản ứng (a) tương ứng với phản ứng không có xúc tác.
Đường phản ứng (b) tương ứng với phản ứng có xúc tác.
Lý thuyết Các yếu tố ảnh hưởng đến tốc độ phản ứng
1. Ảnh hưởng của nồng độ đến tốc độ phản ứng
Khi nồng độ chất phản ứng tăng lên, số va chạm giữa các hạt tăng lên, làm số va chạm hiệu quả cũng tăng lên và dẫn đến tốc độ phản ứng tăng.
Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ thuận với tích số nồng độ các chất phản ứng với số mũ thích hợp. Đối với phản ứng đơn giản (phản ứng chỉ xảy ra qua một giai đoạn), số mũ là hệ số của chất tham gia trong phương trình hóa học.
Ví dụ: Xét phản ứng: 2NO + O2 2NO (1).
Từ thực nghiệm, xác định được mối liên hệ giữa tốc độ phản ứng (1) và nồng độ các chất tham gia phản ứng:.
Trong đó: CNO và là nồng độ mol của NO và O2 tại thời điểm đang xét; k được gọi là hằng số tốc độ phản ứng; v là tốc độ phản ứng tại thời điểm đang xét.
Xét tại thời điểm và , khi đó v = k. Như vậy: hằng số tốc độ k là tốc độ phản ứng khi nồng độ của tất cả các chất đầu đều bằng đơn vị.
Chú ý: Đại lượng k đặc trưng cho mỗi phản ứng và chỉ phụ thuộc vào nhiệt độ, không phụ thuộc vào nồng độ chất phản ứng. Giá trị của k được xác định từ thực nghiệm.
2. Ảnh hưởng của áp suất đến tốc độ phản ứng
Tăng áp suất hỗn hợp khí sẽ làm tốc độ phản ứng tăng.
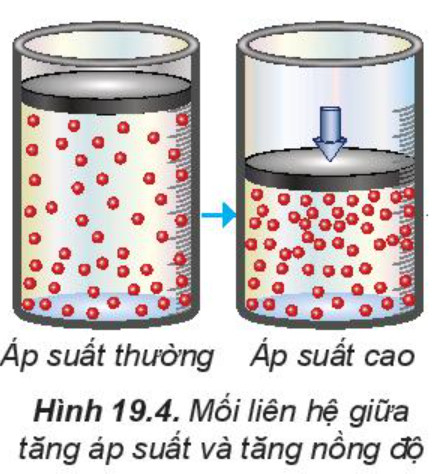
Chú ý: Việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng không có chất khí tham gia.
3. Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
Thực nghiệm cho thấy khi tăng nhiệt độ lên 10oC thì tốc độ phản ứng thường tăng từ 2 đến 4 lần.
Gọi vT là tốc độ phản ứng tại nhiệt độ T, vT + 10 là tốc độ phản ứng tại nhiệt độ T + 10, khi đó: .
Trong biểu thức trên, g được gọi là hệ số nhiệt độ Van’t Hoff (Van-Hốp). Giá trị g càng lớn thì ảnh hưởng của nhiệt độ đến tốc độ phản ứng càng mạnh.
Ví dụ: Xét phản ứng của acetone và iodine: CH3COCH3 + I2 CH3COCH2I + HI.
Phản ứng có hệ số nhiệt g trong khoảng từ 30oC đến 50oC là 2,5. Ở 35oC, phản ứng có tốc độ là 0,036 mol/(L.h). Tính tốc độ phản ứng ở 45oC.
Hướng dẫn giải:
(mol/(L.h)).
4. Ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng
Ví dụ: Nghiên cứu ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng:
CaCO3 + 2HCl CaCl2 + CO2 + H2O
Tiến hành thí nghiệm:
- Cho cùng một lượng (khoảng 2 g) đa vôi dạng viên vào bình tam giác (1) và đá vôi đập nhỏ vào bình tam giác (2).
- Rót 20 ml dung dịch HCl 0,5M vào mỗi bình.
Nhận xét: Phản ứng trong bình (2) có tốc độ thoát khí nhanh hơn.
Khi tăng diện tích bề mặt tiếp xúc, số va chạm giữa các chất đầu tăng lên, số va chạm hiệu quả cũng tăng theo, dẫn đến tốc độ phản ứng tăng.
5. Ảnh hưởng của chất xúc tác đến tốc độ phản ứng
Chất xúc tác làm tăng tốc độ phản ứng nhưng nó không bị biến đổi về lượng và chất sau phản ứng.
Ví dụ: Thực hiện hai phản ứng phân hủy H2O2: một phản ứng có xúc tác MnO2, một phản ứng không xúc tác. Đo thể tích khí oxygen theo thời gian và biểu diễn trên đồ thị như sau:
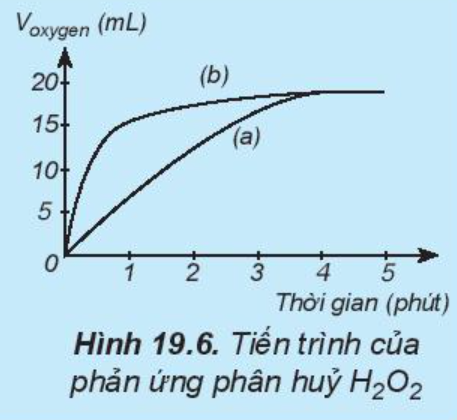
Nhận xét: Đường phản ứng (b) có tốc độ thoát khí oxygen nhanh hơn, do đó phản ứng (b) có xúc tác MnO2.
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Câu hỏi 1 trang 93 Hóa học 10: Xét phản ứng H2 + Cl2 → 2HCl...
Câu hỏi 2 trang 94 Hóa học 10: Cho phản ứng của các chất ở thể khí...
Câu hỏi 3 trang 96 Hóa học 10: Cho phản ứng của các chất ở thể khí: X + Y → XY...
Câu hỏi 4 trang 97 Hóa học 10: Nêu mối liên hệ giữa nồng độ và áp suất của khí trong hỗn hợp....
Câu hỏi 5 trang 97 Hóa học 10: Áp suất ảnh hưởng đến tốc độ phản ứng nào sau đây?...
Câu hỏi 6 trang 98 Hóa học 10: Hãy giải thích tại sao khi nhiệt độ tăng thì tốc độ phản ứng tăng....
Câu hỏi 7 trang 98 Hóa học 10: Nêu ý nghĩa của hệ số nhiệt độ Van’t Hoff....
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 22: Hydrogen halide. Muối halide