Với giải sách bài tập Hóa học 10 Bài 3: Nguyên tố hóa học sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 10. Mời các bạn đón xem:
Giải SBT Hóa học lớp 10 Bài 3: Nguyên tố hóa học
A. tính chất hóa học.
B. khối lượng nguyên tử.
C. số proton.
D. số electron.
Lời giải:
Đáp án đúng là: B
Đồng vị là những nguyên tử của cùng một nguyên tố hóa học, nhưng khác nhau về khối lượng nguyên tử.
A.
B.
C.
D. Không thể xác định được.
Lời giải:
Đáp án đúng là: A
Gọi x, y, z lần lượt là % số nguyên tử của mỗi đồng vị . Ta có công thức tính nguyên tử khối trung bình:
Do nguyên tử khối trung bình của hydrogen bằng 1,008 ≈ 1 nên đồng vị chiếm tỉ lệ phần trăm số nguyên tử nhiều nhất trong tự nhiên.
Lời giải:
a – 2; b – 1; c – 4; d – 3
Giải thích:
có số neutron bằng: 65 – 29 = 36.
có số neutron bằng: 63 – 29 = 34.
có số neutron bằng: 40 – 18 = 22.
có số neutron bằng: 40 – 19 = 21.
là kí hiệu hóa học sai vì K có số proton là 19.
Bài 3.4 trang 8 sách bài tập Hóa học 10: Cặp nguyên tử nào sau đây có cùng số neutron?
A. và
B. và
C. và
D. và
Lời giải:
Đáp án đúng là: A
và có cùng số neutron là 6.
A. D-.
B. H3O+.
C. OD-.
D. OH-.
Lời giải:
Đáp án đúng là: D
A. 6,07.
B. 6,50.
C. 6,90.
D. 6,93.
Lời giải:
Đáp án đúng là: D
Nguyên tử khối trung bình của mẫu lithium này (kết quả tính đến hai chữ số thập phân) là:
Biết rằng nguyên tử khối trung bình của Ne là 20,18. Giá trị số khối A của đồng vị đầu tiên là
A. 19,00.
B. 20,00.
C. 20,01.
D. Không xác định được.
Lời giải:
Đáp án đúng là: B
Áp dụng công thức tính nguyên tử khối trung bình có:
A. 6.
B. 9.
C. 12.
D. Vô số.
Lời giải:
Đáp án đúng là: C
Các loại phân tử CO2 có thể tạo ra từ các đồng vị này là:
16O 12C 16O; 16O 12C 17O; 16O 12C 18O; 17O 12C 18O; 18O 12C 18O; 17O 12C 17O;
16O 13C 16O; 16O 13C 17O; 16O 13C 18O; 17O 13C 18O; 18O 13C 18O; 17O 13C 17O;
Số lượng đồng vị bền và nguyên tử khối trung bình của zirconium là
A. 5 đồng vị, nguyên tử khối trung bình bằng 92,60.
B. 5 đồng vị, nguyên tử khối trung bình bằng 91,32.
C. 4 đồng vị, nguyên tử khối trung bình bằng 91,18.
D. 4 đồng vị, nguyên tử khối trung bình bằng 92,00.
Lời giải:
Đáp án đúng là: B
Quan sát phổ khối lượng của zirconium xác định được nguyên tố này có 5 đồng vị.
Nguyên tử khối trung bình của zirconium:
Lời giải:
Nguyên tử khối trung bình của Ag là:
Lời giải:
Đáp án đúng là: A
Gọi % số nguyên tử của mỗi đồng vị 63Cu và 65Cu lần lượt là x và y (%).
Theo bài ra, ta có hệ phương trình:
Hình vẽ phổ khối đúng là: A
CH2 = CH – CH2 – CH2 – CH = CHD ⇌ CH2 = CH – CH2 – CHD – CH = CH2 (1)
Vậy cũng trong điều kiện đó, phản ứng sau đây có xảy ra không?
CD2 = CD – CD2 – CD2 – CD = CDT ⇌ CD2 = CD – CD2 – CDT – CD = CD2 (2)
Lời giải:
Phản ứng (2) có xảy ra bởi vì phản ứng (1) xảy ra; vai trò của D và T là như nhau.
Xem thêm các bài giải SBT Hoá học lớp 10 Cánh diều hay, chi tiết khác:
Bài 2: Các thành phần của nguyên tử
Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 5: Lớp, phân lớp và cấu hình electron
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Lý thuyết Nguyên tố hóa học
I. Nguyên tố hóa học
1. Khái niệm nguyên tố hóa học
- Nguyên tố hóa học là tập hợp các nguyên tử có cùng số hạt proton.
Ví dụ: Ba loại nguyên tử trong hình dưới đây đều có một proton (hạt màu xanh) trong hạt nhân nên thuộc cùng một nguyên tố hóa học, nguyên tố hydrogen (H).
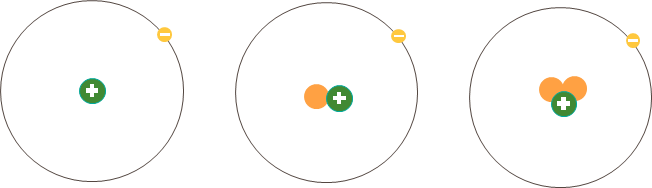
Hình 3.1. Minh họa cấu tạo một số loại nguyên tử của nguyên tố hydrogen
2. Số hiệu nguyên tử, số khối, kí hiệu nguyên tử
- Số proton trong một hạt nhân nguyên tử được gọi là số hiệu nguyên tử, kí hiệu là Z.
Ví dụ: Hạt nhân nguyên tử lithium (Li) có 3 proton, vậy số hiệu nguyên tử của Li là 3 (ZLi = 3).
- Tổng số proton (Z) và neutron (N) trong một hạt nhân nguyên tử được gọi là số khối, kí hiệu là A.
A = Z + N
Như vậy, số khối chính bằng tổng số hạt có trong hạt nhân nguyên tử. Giá trị này xấp xỉ bằng giá trị khối lượng nguyên tử (tính theo đơn vị amu).
Ví dụ: Một loại nguyên tử sodium (Na) có 11 hạt proton, 11 electron và 12 hạt neutron. Số khối của nguyên tử Na = Z + N = P + N = 11 + 12 = 23 (amu)
- Kí hiệu nguyên tử cho biết kí hiệu hóa học của nguyên tố (X), số hiệu nguyên tử (Z) và số khối (A).

Hình 3.2. Kí hiệu nguyên tử của helium
Lưu ý: Đôi khi, người ta viết tắt kí hiệu nguyên tử.
Ví dụ: Sử dụng 4He thay cho , bởi kí hiệu He đã cho biết đây là nguyên tử nguyên tố helium, hạt nhân có 2 proton.
II. Đồng vị, nguyên tử khối trung bình
1. Đồng vị
- Các nguyên tử của cùng một nguyên tố hóa học có số neutron khác nhau là đồng vị của nhau.
Do đó, đồng vị của cùng một nguyên tố hóa học (có cùng số proton) khác nhau về số khối do đó số neutron khác nhau.
Ví dụ: Helium có hai đồng vị bền là và .
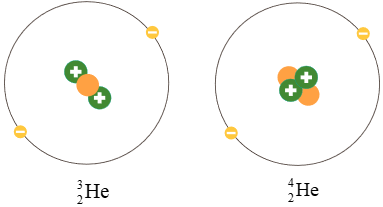
Hình 3.3. Minh họa cấu tạo nguyên tử hai đồng vị của nguyên tố helium
- Tất cả các nguyên tố hóa học đều có nhiều đồng vị.
Ví dụ: Hydrogen có ba đồng vị là (kí hiệu là H), (kí hiệu là D), (kí hiệu là T), oxygen có 17 đồng vị bắt đầu từ và kết thúc là , ...
2. Nguyên tử khối trung bình
a) Nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của một nguyên tử, cho biết khối lượng của một nguyên tử nặng gấp bao nhiêu lần 1 amu.
Ví dụ: Nguyên tử khối của 16O là 16 do khối lượng của một nguyên tử 16O là 16 amu.
b) Nguyên tử khối trung bình
- Mỗi nguyên tố hóa học đều có nhiều đồng vị.
- Trong tự nhiên, một nguyên tố hóa học dù ở dạng đơn chất hay hợp chất thì tỉ lệ giữa các đồng vị của nguyên tố này là không đổi.
- Nguyên tử khối của nguyên tố hóa học có nhiều đồng vị là nguyên tử khối trung bình của các đồng vị (kí hiệu là ![]() ), có tính đến tỉ lệ số nguyên tử các đồng vị tương ứng (xác định từ phổ khối lượng).
), có tính đến tỉ lệ số nguyên tử các đồng vị tương ứng (xác định từ phổ khối lượng).
- Công thức tính nguyên tử khối trung bình như sau:
=
Trong đó:
+ X, Y, Z, ... lần lượt là số khối của các đồng vị.
+ x, y, z, ... là phần trăm số nguyên tử các đồng vị tương ứng.
Ví dụ: Trong tự nhiên, đồng có hai đồng vị bền là 63Cu và 65Cu chiếm tương ứng khoảng 73% và 27% về số nguyên tử. Nguyên tử khối trung bình của đồng là:
= = 63,64
Lưu ý: Nguyên tử khối của một nguyên tố hóa học ghi trong bảng tuần hoàn là nguyên tử khối trung bình của các đồng vị trong tự nhiên.