Với giải sách bài tập Hóa học 10 Bài 2: Các thành phần của nguyên tử sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 10. Mời các bạn đón xem:
Giải SBT Hóa học lớp 10 Bài 2: Các thành phần của nguyên tử
Bài 2.1 trang 4 sách bài tập Hóa học 10:Phát biểu nào sau đây là không đúng?
A. Tất cả các nguyên tử đều có proton, neutron và electron.
B. Proton và electron là các hạt mang điện, neutron là hạt không mang điện.
C. Electron tạo nên lớp vỏ nguyên tử.
D. Số lượng proton và electron trong nguyên tử là bằng nhau.
Lời giải:
Đáp án đúng là: A
Nguyên tử hydrogen chỉ gồm proton và electron, không có neutron.
a) Trong nguyên tử, khối lượng tập trung chủ yếu ở …..
b) Kích thước hạt nhân rất ….. so với kích thước nguyên tử.
c) Trong nguyên tử, phần không gian ….. chiếm chủ yếu.
d) Trong thí nghiệm của Thomson, hạt tạo nên tia âm cực là …..
Lời giải:
a) Trong nguyên tử, khối lượng tập trung chủ yếu ở hạt nhân.
b) Kích thước hạt nhân rất nhỏ so với kích thước nguyên tử.
c) Trong nguyên tử, phần không gian rỗng chiếm chủ yếu.
d) Trong thí nghiệm của Thomson, hạt tạo nên tia âm cực là electron.
Bài 2.3 trang 4 sách bài tập Hóa học 10:Những phát biểu nào sau đây là đúng?
A. Nếu một nguyên tử có 17 electron thì nguyên tử đó cũng có 17 proton.
B. Nếu một nguyên tử có 17 electron thì nguyên tử đó cũng có 17 neutron.
C. Nếu một nguyên tử có 17 electron thì ion tạo ra từ nguyên tử đó có 17 proton.
D. Nếu một nguyên tử có 17 electron thì ion tạo ra từ nguyên tử đó có 17 neutron.
E. Nếu một nguyên tử có 17 electron thì ion tạo ra từ nguyên tử đó có 17 electron.
Lời giải:
Đáp án đúng là: A và C
Trong nguyên tử, số proton bằng số electron. Các ion được tạo ra từ nguyên tử đó có số proton bằng số proton của nguyên tử nhưng khác số electron.
B sai vì số neutron trong nguyên tử có thể bằng hoặc khác số electron, không thể xác định số neutron của nguyên tử bằng cách dựa vào số electron.
D sai vì không thể xác định số neutron của ion bằng việc dựa vào số electron.
E sai vì số electron của ion khác số electron của nguyên tử. Nếu nguyên tử mất electron thì tạo ion dương; nếu nguyên tử nhận electron thì tạo ion âm.
Lời giải:
Bài 2.5 trang 4 sách bài tập Hóa học 10:Những phát biểu nào dưới đâykhông đúng?
A. Điện tích của proton và electron có cùng độ lớn nhưng ngược dấu.
B. Có những nguyên tử không chứa neutron nào.
C. Một số nguyên tử không có bất kì proton nào.
D. Điện tích của proton và neutron có cùng độ lớn nhưng ngược dấu.
E. Trong nguyên tử, số hạt proton luôn bằng số hạt electron.
G. Khối lượng của proton và neutron xấp xỉ bằng nhau và lớn hơn nhiều khối lượng của electron.
Lời giải:
Đáp án đúng là C và D.
Phát biểu C sai vì nguyên tử bắt buộc phải có proton.
Phát biểu D sai vì neutron không mang điện.
A. Nguyên tử đồng có 29 electron.
B. Hạt nhân nguyên tử đồng trên có tổng số hạt là 63.
C. Ion Cu+ có 28 electron.
D. Ion Cu+ có 30 electron.
E. Ion Cu+ có 28 proton.
Lời giải:
Đáp án đúng là: A, B, C
A đúng vì nguyên tử đồng có số electron = số proton = 29.
B đúng vì số hạt trong hạt nhân nguyên tử đồng = 29 + 34 = 63.
C đúng, D sai vì Cu nhường 1 electron tạo ion Cu+. Số electron của Cu+ = 29 – 1 = 28.
E sai vì ion Cu+ có số proton là 29 (bằng số proton của Cu).
Biết nguyên tử H có 1 proton và 1 electron. Số proton, neutron và electron của ion lần lượt là
A. 2 p; 1 n và 1 e.
B. 2 p; 1 n và 2 e.
C. 3 p; 0 n và 1 e.
D. 3 p; 0 n và 2 e.
Lời giải:
Đáp án đúng là: D
+ Số proton của ion bằng tổng số proton của 3 nguyên tử H là 3.
+ Nguyên tử H không có neutron nên ion cũng không có neutron.
+ Vì ion mang điện tích 1+ nên số proton nhiều hơn số electron là 1, vậy ion có 2 electron.
Lời giải:
a nối với 1, 2, 5.
b nối với 1, 3, 4, 5.
Giải thích:
- Phân tử CO:
+ Có số proton = số neutron = 6 + 8 = 14
+ Khối lượng = (6 . 1 + 6 . 1) + (8 . 1 + 8 . 1) = 28 amu
+ Số hạt mang điện là 2 . (6 + 8) = 28 gấp đôi số hạt không mang điện là 14
- Phân tử CO2:
+ Có số proton = số neutron = số electron = 6 + 8 . 2 = 22
+ Khối lượng = (6 . 1 + 6 . 1) + 2.(8 . 1 + 8 . 1) = 44 amu
+ Số hạt mang điện là 2 . (6 + 8.2) = 44 gấp đôi số hạt không mang điện là 22
A. 11 proton và 10 electron.
B. 11 proton và 11 electron.
C. 10 proton và 11 electron.
D. 10 proton và 10 electron.
Lời giải:
Đáp án đúng là: A
Lời giải:
Đường kính hạt nhân nguyên tử trong mô hình bằng: 1 × 10-5 = 10-5 m = 0,01 mm.
0,01 mm rất nhỏ nên mô hình hạt nhân nguyên tử này không thể chế tạo được bằng dụng cụ thông thường và không phù hợp để quan sát được bằng mắt thường.
Biết rằng 1 fm = 10-15 m, 1 pm = 10-12m.
Lời giải:
Coi nguyên tử và hạt nhân nguyên tử có dạng hình cầu.
Đổi 2,7 fm = 2,7 × 10-15 m.
70 pm = 70 × 10-12 m = 7 × 10-11 m.
Thể tích của hạt nhân nguyên tử là:
Thể tích của nguyên tử là:
Phần trăm thể tích nguyên tử carbon bị chiếm bởi hạt nhân là:
Lời giải:
Do kích thước hạt nhân bằng 10-5 lần kích thước nguyên tử nên nếu giả thiết chỉ còn x hạt nhân nguyên tử sắp xếp chặt khít cạnh nhau trong một khối cầu thì bán kính Trái Đất còn:
6 371 × 10-5 = 0,06371 km = 63,71 m.
Hay bán kính Trái Đất khi đó nhỏ đi 105 lần.
a) Tính khối lượng riêng của neutron, coi neutron có dạng hình cầu.
b) Giả sử một ngôi sao neutron có cùng khối lượng riêng với neutron, hãy tính khối lượng (theo kg) của một mảnh ngôi sao neutron có kích thước bằng một hạt cát hình cầu với bán kính 0,10 mm.
Lời giải:
a) Khối lượng của 1 neutron ≈ 1u ≈ 1,6605 × 10-27 kg.
Coi neutron có dạng hình cầu, thể tích của 1 neutron là:
Khối lượng riêng của neutron là:
b) Thể tích của mảnh sao là:
Khối lượng của mảnh sao là:
m = d. V = 3,9661 × 1017 × 4,1867 × 10-12 = 1,6605 × 106 kg = 1660,5 tấn.
a) Hãy cho biết trong trường hợp này, cơ thể chúng ta đã nhận thêm hay mất đi electron.
b) Tổng khối lượng của các electron mà cơ thể đã nhận thêm hoặc mất đi là bao nhiêu kilôgam? Cho khối lượng của 1 electron là 9,1 × 10-31 kg.
Biết rằng 1 μC = 10-6 C.
Lời giải:
a) Do cơ thể tích một lượng điện tích âm nên đã nhận thêm electron.
b) Điện tích của 1 electron là – 1,602 × 10-19 C.
Số lượng electron ứng với điện tích – 10 μC (micrôculông) là:
Tổng khối lượng electron là: 9,1 × 10-31 × 6,242 × 1013 = 5,7 × 10-17 (kg).
- Hầu hết các hạt α xuyên thẳng qua lá vàng.
- Một số ít hạt α bị lệch quỹ đạo so với ban đầu.
- Một số rất ít hạt α bị bật ngược trở lại.
Từ kết quả này, em có nhận xét gì về cấu tạo nguyên tử?
Lời giải:
Trong thí nghiệm của Rutherford, khi sử dụng các hạt alpha (ion He2+, kí hiệu là α) bắn vào lá vàng thì:
- Hầu hết các hạt α xuyên thẳng qua lá vàng chứng tỏ nguyên tử có cấu tạo rỗng.
- Một số ít hạt α bị lệch quỹ đạo so với ban đầu chứng tỏ hạt nhân nguyên tử cùng điện tích dương như hạt hạt alpha (ion He2+, kí hiệu là α).
- Một số rất ít hạt α bị bật ngược trở lại chứng tỏ kích thước hạt nhân nhỏ hơn rất nhiều so với kích thước của nguyên tử và khối lượng nguyên tử tập trung chủ yếu ở hạt nhân.
Xem thêm các bài giải SBT Hoá học lớp 10 Cánh diều hay, chi tiết khác:
Bài 2: Các thành phần của nguyên tử
Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 5: Lớp, phân lớp và cấu hình electron
Lý thuyết Thành phần của nguyên tử
I. Thành phần và cấu trúc của nguyên tử
1. Thành phần nguyên tử
- Mọi vật thể đều được tạo nên từ các chất và mọi chất đều được tạo nên từ các nguyên tử.
- Nguyên tử được tạo nên từ 3 loại hạt cơ bản là:
+ Hạt electron, kí hiệu là e
+ Hạt proton, kí hiệu là p
+ Hạt neutron, kí hiệu là n
- Khối lượng và điện tích các hạt cơ bản này được thể hiện trong Bảng 2.1.
Bảng 2.1. Khối lượng và điện tích của các hạt cấu tạo nên nguyên tử
|
Loại hạt |
Electron |
Proton |
Neutron |
|
Khối lượng (amu) |
0,00055 |
1 |
1 |
|
Điện tích (e0) |
-1 |
+1 |
0 |
- Trong một nguyên tử, số proton và số electron luôn bằng nhau.
- Trong tất cả các nguyên tố, chỉ có duy nhất một loại nguyên tử của hydrogen (H) được tạo nên bởi proton và electron (không có neutron).
Chú ý:
+ Đơn vị của khối lượng nguyên tử là amu (atomic mass unit)
1 amu = 1,6605.10-27 kg
+ Đơn vị của điện tích các hạt cơ bản là e0 (điện tích nguyên tố)
1 e0 = 1,602.10-19 C
2. Cấu trúc của nguyên tử
Nguyên tử bao gồm:
+ Lớp vỏ: được tạo nên bởi các hạt electron
+ Hạt nhân: được tạo nên bởi các hạt proton và hạt neutron
Ví dụ: Mô hình cấu tạo nguyên tử hydrogen và beryllium
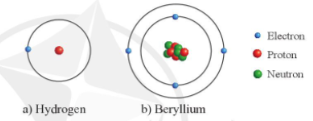
II. Khối lượng và kích thước của nguyên tử
Nguyên tử của các nguyên tố khác nhau có khối lượng và kích thước khác nhau
1. Khối lượng của nguyên tử
- Khối lượng của nguyên tử vô cùng nhỏ.
- Khối lượng nguyên tử thường được biểu thị theo đơn vị amu
- Nguyên tử có khối lượng nhỏ nhất là nguyên tử của nguyên tố hydrogen (H), có khối lượng là 1 amu
- Nguyên tử có khối lượng lớn nhất là nguyên tử của nguyên tố uranium (U), có khối lượng là 238 amu
- Do khối lượng của các electron (0,00055 amu) rất nhỏ so với khối lượng của proton (1 amu) hay neutron (1 amu) nên khối lượng nguyên tử tập trung chủ yếu ở hạt nhân nguyên tử. Một cách gần đúng, có thể coi khối lượng của nguyên tử bằng khối lượng của hạt nhân.
2. Kích thước của nguyên tử
- Kích thước của nguyên tử là vô cùng nhỏ
- Coi nguyên tử có dạng hình cầu, khi đó, đường kính của nó chỉ khoảng 10-10 m
- Nguyên tử có đường kính nhỏ nhất là helium (0,62), nguyên tử có đường kính lớn nhất là francium (7,0)
Chú ý: Angstrom là đơn vị đo độ dài, kí hiệu là
1 = 102 pm = 10-10 m
- Hạt nhân nguyên tử có kích thước rất nhỏ so với nguyên tử. Kích thước hạt nhân bằng khoảng 10-5 đến 10-4 lần kích thước nguyên tử. Như vậy, phần không gian rỗng chiếm chủ yếu trong nguyên tử.