Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 11 Bài 38: Hệ thống hóa về hiđrocacbon chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Hệ thống hóa về hiđrocacbon lớp 11.
Giải bài tập Hóa học lớp 11 Bài 38: Hệ thống hóa về hiđrocacbon
Câu hỏi và bài tập ( trang 172 SGK Hóa học 11)
Bài 1 trang 172 SGK Hóa học 11: So sánh tính chất hóa học của:
a) anken với ankin b) ankan với ankylbenzen.
Cho thí dụ minh họa.
Phương pháp giải :
a)
So sánh tính chất hóa học giống nhau ( cộng H2, cộng dd Br2dd thuốc tím)
Tính chất hóa học khác nhau: ank-1-in có phản ứng với AgNO3 trong NH3
b)
Tính chất hóa học giống nhau: có phản ứng thế; phản ứng tách
Tính chất hóa học khác nhau: có phản ứng cộng H2 ; phản ứng làm mất màu dd thuốc tím khi đun nóng
Lời giải :
a) So sánh tính chất hóa học anken và ankin:
- Giống nhau:
+ Cộng hiđro ( xúc tác Ni, t0)
CH2=CH2 + H2 CH3-CH3
CH≡CH + H2 CH3-CH3
+ Cộng brom (dung dịch).
CH2=CH2 + Br2 → CH2Br-CH2Br
CH≡CH + 2Br2 → CHBr2-CHBr2
+ Cộng HX theo quy tắc Mac-côp-nhi-côp.
+ Làm mất màu dung dịch KMnO4.
3CH≡CH + 4H2O + 8KMnO4 → 3(COOH)2 + 8MnO2↓ + 8KOH
3CH2=CH2 +2KMnO4+ 4H2O → 3CH2(OH)-CH2(OH) + 2MnO2↓ + 2KOH
- Khác nhau:
+ Anken: Không có phản ứng thế bằng ion kim loại.
+ Ankin: Ank-1-in có phản ứng thế bằng ion kim loại.
CH≡CH + 2AgNO3 + 2NH3 → Ag-CH-CH-Ag↓ (vàng) + 2NH4NO3
b) ankan và ankylbenzen
- Giống nhau:
+ phản ứng thế với halogen:
CH3-CH2-CH3 + Cl2 CH3-CHCl-CH3 + HCl
C6H5CH3 + Cl2 C6H5CH2Cl + HCl
Khác nhau:
+ Ankan có phản ứng tách, còn ankyl benzen thì không
C4H10 → C4H8 + H2
+ ankyl benzen có phản ứng cộng, phản ứng oxi hóa không hoàn toàn với dd KMnO4 còn ankan thì không có.
C6H5CH3 + H2 C6H11CH3
C6H5CH3 +2KMnO4 C6H5COOK + 2MnO2↓ + KOH + H2O
Bài 2 trang 172 SGK Hóa học 11: Trình bày phương pháp hóa học:
a) Phân biệt các khí đựng trong các bình riêng biệt không dán nhãn: H2, O2, CH4, C2H4, C2H2.
b) tách riêng khí CH4 từ hỗn hợp với lượng nhỏ các khí C2H4 và C2H2.
Phương pháp giải :
a) ta thấy 5 khí phân ra là 2 nhóm:
- H2, O2 phân biệt O2 bằng tàn đóm đỏ
- CH4, C2H4, C2H2 là các hiđrocacbon => CH4 chỉ có liên kết đơn, C2H4 có liên kết đôi lên có phản ứng cộng dung dịch nước brom, C2H2 có liên kết ba trong phân tử nên có tác dụng với Ag2O trong NH3 và có phản ứng với dung dịch nước brom => dựa vào đặc điểm khác nhau này để chọn thứ tự các hóa chất cho vào để phân biệt được chúng.
b) như phân tích phần a thì chỉ có CH4 không phản ứng được với dung dịch nước brom => dùng dung dịch nước brom để tách riêng CH4 với 2 khí còn lại
Lời giải :
a) Phân biệt các bình đựng khí riêng biệt: H2, O2, CH4, C2H4, C2H2.
-Dẫn từng khí qua dung dịch AgNO3 trong NH3, khí cho kết tủa vàng nhạt là C2H2.
CH ≡ CH + 2AgNO3 + 2NH3 → AgC ≡ CAg ↓ + 2NH4NO3
-Dẫn lần lượt 4 khí còn lại qua dung dịch brom, khí nào làm mất màu dung dịch bron là khí C2H4.
CH2 = CH2 + Br2 → CH2Br – CH2Br
-Ba khí còn lại, nhận ra khí O2 bằng tàn đóm còn than hồng: khí O2 làm tàn đóm bùng cháy.
- Hai khí còn lại, cho lần lượt từng khí phản ứng với khí oxi, khí nào cho sản phẩm làm đục nước vôi trong là khí CH4.
2H2 + O2 → 2H2O
CH4 + 2O2 → CO2 + 2H2O
CO2 + Ca(OH)2 → CaCO3 + H2O
- Khí còn lại là khí H2
b) Cho hỗn hợp khí đi qua dung dịch Br2 dư, C2H4 và C2H2 sẽ tác dụng hết với dung dịch Br2, khí đi ra là metan.
CH2=CH2 + Br2 (nâu đỏ) → BrCH2-CH2Br (không màu)
CH≡CH + 2Br2 (nâu đỏ) → Br2CH-CHBr2 (không màu)
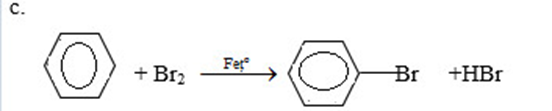
Bài 3 trang 172 SGK Hóa học 11: Viết phương trình hóa học của các phản ứng hoàn thành dãy chuyển hóa sau:
a) Etan etilen polietilen.
b) Metan axetilen vinylaxetilen butanđien polibutađien.
c) Benzen → brombenzen.
phương pháp giải :
Ghi nhớ: từ chất có nhiều H sang chất có ít H ta dùng phản ứng tách
Từ chất có ít H sang chất có nhiều H ta dùng phản ứng cộng với H2 ( xt Ni)
Lời giải :
a)
(1) CH3-CH3 CH2=CH2 + H2
(2) CH2=CH2 ( -CH2-CH2-)n
b)
(1) 2CH4 C2H2 + 3H2
(2) 2C2H2 CH≡C-CH=CH2
(3) CH≡C-CH=CH2 + H2 CH2=CH-CH=CH2
(4) CH2=CH-CH=CH2 (-CH2-CH=CH-CH2-)n
Bài 4 trang 172 SGK Hóa học 11: Viết phương trình hóa học tổng quát của phản ứng đốt cháy các loại hiđrocacbon đã nêu trong bảng 7.2. Nhận xét về tỉ lệ giữa số mol CO2 và số mol H2O trong sản phẩm của mỗi loại hiđrocacbon.
Phương pháp giải :
Viết PTHH đốt cháy của:
- Ankan có công thức chung: CnH2n+2
- Anken có công thức chung: CnH2n
- Ankin có công thức chung: CnH2n-2
- Akylbenzen có công thức chung: CnH2n-6
Lời giải :
1. CnH2n+2 +O2 nCO2 + (n+1)H2O có
2. CnH2n + O2 nCO2 + nH2O có
3. CnH2n-2 + O2 nCO2 + (n-1)H2O có
4. CnH2n-6 + O2 nCO2 + (n-3)H2O có
Bài 5 trang 172 SGK Hóa học 11: Khi đốt cháy hoàn toàn hiđrocacbon X (là chất lỏng ở điều kiện thường) thu được CO2 và H2O có số mol theo tỉ lệ 2 : 1. Công thức phân tử của X có thể là công thức nào sau đây?
A. C4H4. B. C5H12.
C. C6H6. D. C2H2.
Phương pháp giải :
Chất X là chất lỏng ở điều kiện thường => số C phải từ 4C trở lên
ta thấy tỉ lệ CO2 lớn hơn H2O => X phải có chứa từ 2 liên kết pi trở lên
Thấy chỉ có C6H6 là thỏa mãn
Lời giải :
Chất X là chất lỏng ở điều kiện thường => số C phải từ 5C trở lên
Khi đốt cháy X thu được CO2 và H2O có số mol theo tỷ lệ 2:1
X có số C bằng số H
Thấy chỉ có C6H6 là thỏa mãn
Đáp án C
A. Kiến thức trọng tâm
- Hệ thống hóa các loại hiđrocacbon quan trọng: ankan, anken, ankađien, ankin và ankylbenzen về đặc điểm cấu tạo, tính chất vật lí, tính chất hóa học đặc trưng và ứng dụng.
- Thông qua việc hệ thống hóa các loại hiđrocacbon. HS nắm mối quan hệ giữa các hiđrocacbon với nhau.
- Viết được các phương trình hóa học minh họa cho tính chất của các hiđrocacbon; chuyển hóa giữa các hiđrocacbon, nhận biết và điều chế các hiđrocacbon.
- Làm được một số bài tập về hiđrocacbon.