Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 9 Bài 31: Sơ lược bảng tuần hoàn các nguyên tố hóa học chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Sơ lược bảng tuần hoàn các nguyên tố hóa học lớp 9.
Giải bài tập Hóa học lớp 9 Bài 31: Sơ lược bảng tuần hoàn các nguyên tố hóa học
Câu hỏi và bài tập ( trang 101 SGK Hóa học 9)
Bài 1 trang 101 SGK Hóa học 9: Dựa vào bảng tuần hoàn, hãy cho biết cấu tạo nguyên tử, tính chất kim loại, phi kim của các nguyên tố có số hiệu nguyên tử 7, 12, 16.
Lời giải:
+ Giả sử nguyên tố A có số hiệu nguyên tử là 7 A thuộc ô số 7 trong bảng tuần hoàn, có điện tích hạt nhân là 7+, có 7 electron. Dựa vào bảng tuần hoàn ta thấy nguyên tố A thuộc chu kì 2 có 2 lớp electron. Nguyên tố A thuộc nhóm VA có 5 electron lớp ngoài cùng và A là phi kim
+ Giả sử nguyên tố B có số hiệu nguyên tử là 12 B thuộc ô số 12 trong bảng tuần hoàn, có điện tích hạt nhân là 12+, có 12 electron. Dựa vào bảng tuần hoàn ta thấy nguyên tố B thuộc chu kì 3 có 3 lớp electron. Nguyên tố B thuộc nhóm IIA có 2 electron lớp ngoài cùng và B là kim loại
+ Giả sử nguyên tố C có số hiệu nguyên tử là 16 C thuộc ô số 16 trong bảng tuần hoàn, có điện tích hạt nhân là 16+, có 16 electron. Dựa vào bảng tuần hoàn ta thấy nguyên tố C thuộc chu kì 3 có 3 lớp electron. Nguyên tố C thuộc nhóm VIA có 6 electron lớp ngoài cùng và C là phi kim.
Ta được kết quả như trong bảng:
|
Cấu tạo nguyên tử |
Tính chất |
||||
|
Điện tích hạt nhân |
Số e trong nguyên tử |
Số lớp electron |
Số e lớp ngoài cùng |
Kim loại |
Phi kim |
|
7+ |
7 |
2 |
5 |
|
x |
|
12+ |
12 |
3 |
2 |
x |
|
|
16+ |
16 |
3 |
6 |
|
x |
Bài 2 trang 101 SGK Hóa học 9: Biết X có cấu tạo nguyên tử như sau : điện tích hạt nhân là 11+, 3 lớp electron, lớp ngoài cùng có 1 electron. Hãy suy ra vị trí của X trong bảng tuần hoàn và tính chất hoá học cơ bản của nó
Lời giải:
+ Vì điện tích hạt nhân là 11+ nên số thứ tự của nguyên tố là 11 (ô số 11)
+ Có 3 lớp electron nguyên tố thuộc chu kì 3 của bảng tuần hoàn
+ Có 1 electron lớp ngoài cùng nguyên tố thuộc nhóm I trong bảng tuần hoàn
Dựa vào bảng tuần hoàn các nguyên tố hóa học
+ Tên nguyên tố: natri
+ Kí hiệu hóa học: Na
+ Nguyên tử khối: 23
+ Tính chất hóa học cơ bản: kim loại
Bài 3 trang 101 SGK Hóa học 9: Các nguyên tố trong nhóm I đều là những kim loại mạnh tương tự natri : tác dụng với nước tạo thành dung dịch kiềm và giải phóng hiđro, tác dụng với oxi tạo thành oxit, tác dụng với phi kim khác tạo thành muối ... Viết các phương trình hoá học minh hoạ với kali.
Lời giải:
Kali tác dụng với nước tạo thành dung dịch bazơ và khí hiđro:
2K + 2H2O 2KOH + H2
Kali tác dụng với oxi tạo thành oxit:
4K + O2 2K2O
Kali tác dụng với phi kim (khác oxi) tạo thành muối:
2K + Cl2 2KCl
Bài 4 trang 101 SGK Hóa học 9: Các nguyên tố nhóm VII đều là những phi kim mạnh tương tự clo (trừ At): tác dụng với hầu hết kim loại tạo muối, tác dụng với hiđro tạo hợp chất khí. Viết phương trình hoá học minh hoạ với brom.
Lời giải:
Brom tác dụng với hầu hết kim loại (trừ Au và Pt) sinh ra muối:
Br2 + 2K 2KBr
Brom tác dụng với hiđro sinh ra sản phẩm khí hiđro bromua:
Br2 + H2 2HBr (k)
Bài 5 trang 101 SGK Hóa học 9: Hãy cho biết cách sắp xếp nào sau đây đúng theo chiều tính kim loại giảm dần :
a) Na, Mg, Al, K ;
b) K, Na, Mg, Al;
c) Al, K, Na, Mg ;
d) Mg, K, Al, Na.
Giải thích sự lựa chọn.
Lời giải:
Cách sắp xếp đúng là b): K, Na, Mg, Al.
Vì:
+ Na và K trong cùng một nhóm, mà điện tích hạt nhân của Na nhỏ hơn điện tích hạt nhân của K nên tính kim loại của Na < K
+ Na, Mg, Al trong cùng một chu kì, mà điện tích hạt nhân của Na < Mg < Al nên tính kim loại của Na > Mg > Al
Theo tính chất bắc cầu, tính kim loại của K > Na > Mg > Al.
Bài 6 trang 101 SGK Hóa học 9: Hãy sắp xếp các nguyên tố sau theo chiều tính phi kim tăng dần : F, O, N, P, As
Lời giải:
Vị trí các nguyên tố trên trong bảng tuần hoàn:

Các nguyên tố theo chiều tính phi kim tăng dần là As, P, N, O, F.
Vì:
+ N, P và As trong cùng một nhóm, mà điện tích hạt nhân của N < P < As nên tính phi kim của N > P > As
+ N, O và F trong cùng một chu kì, mà điện tích hạt nhân của N < O < F nên tính phi kim của N < O < F
Theo tính chất bắc cầu, tính phi kim của As < P < N < O < F.
Bài 7 trang 101 SGK Hóa học 9:
a) Hãy xác định công thức của hợp chất khí A, biết rằng:
- A là oxit của lưu huỳnh chứa 50% oxi.
- 1 gam khí A chiếm thể tích là 0,35 lít ở đktc.
b) Hoà tan 12,8 gam hợp chất khí A vào 300 ml dung dịch NaOH 1,2M. Hãy cho biết muối nào thu được sau phản ứng. Tính nồng độ mol của muối (giả thiết thể tích dung dịch thay đổi không đáng kể).
Lời giải :
nA = = 0,015625 mol.
MA = = 64g
Đặt công thức phân tử của A là SxOy
Lập tỷ số về khối lượng để tính các chỉ số x và y
Vậy công thức phân tử của A là SO2
b.
Đổi 300 ml = 0,3 lít
Ta thấy Phản ứng tạo 2 muối Na2SO3 và NaHSO3
Phương trình phản ứng:
(1)
x x x
(2)
y 2y y
Gọi
Theo phương trình (1) và (2): (*)
Theo phương trình (1) và (2): (**)
Từ (*) và (**) x = 0,04; y = 0,16
Lý thuyết Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hoá học
Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
1. Ô nguyên tố
- Ô nguyên tố cho biết: Số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố đó.
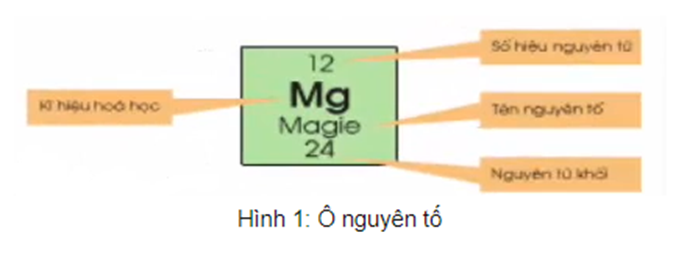
- Số hiệu nguyên tử có số trị bằng số đơn vị điện tích hạt nhân và bằng số electron trong nguyên tử. Số hiệu nguyên tử trùng với số thứ tự ô trong bảng tuần hoàn.
Ví dụ: Ô thứ 11, xếp nguyên tố natri (Na).
Ta có:
+ Số hiệu nguyên tử = số proton = số electron = 11
+ Kí hiệu hóa học: Na
+ Tên nguyên tố: natri
+ Nguyên tử khối: 23
2. Chu kì
- Chu kỳ là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được xếp theo chiều điện tích hạt nhân tăng dần.
- Số thứ tự chu kì bằng số lớp electron.
- Bảng tuần hoàn gồm có 7 chu kỳ: chu kỳ 1, 2, 3 là các chu kỳ nhỏ. Chu kỳ 4, 5, 6, 7 là các chu kỳ lớn.
Ví dụ: chu kì 3: bắt đầu là kim loại kiềm Na và kết thúc là khí trơ: Ar (agon)
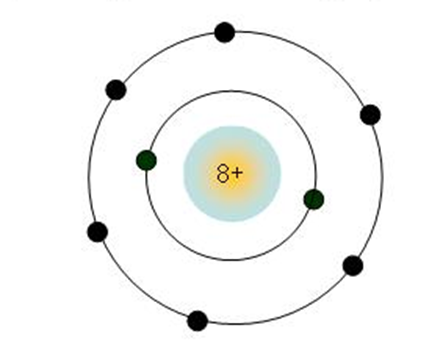
- Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau, do đó có tính chất tương tự nhau được xếp thành một cột theo chiều tăng của điện tích hạt nhân nguyên tử.
- Số thứ tự của các nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử trong nhóm đó.
Ví dụ:
+ Nhóm IA: Gồm các nguyên tố kim loại hoạt động mạnh. Nguyên tử của chúng đều có 1 electron ở lớp ngoài cùng. Điện tích hạt nhân tăng từ Li (3+), … đến Fr (87+).
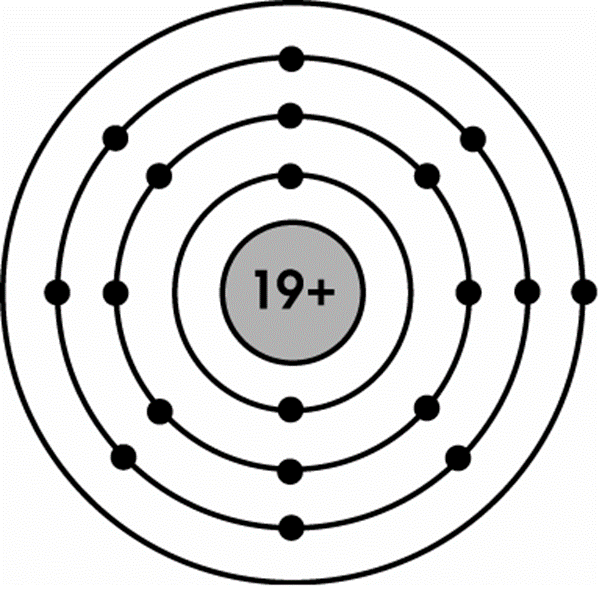
+ Mô phỏng cấu tạo nguyên tử Kali ở nhóm IA, có 1 electron ở lớp ngoài cùng:
1. Trong một chu kì
- Trong một chu kỳ, khi đi từ đầu đến cuối chu kỳ theo chiều tăng của điện tích hạt nhân:
+ Số e lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
+ Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dần.
Ví dụ:
Chu kì 2 gồm 8 nguyên tố:
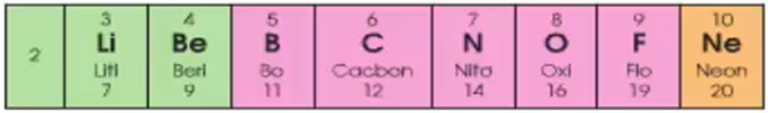
+ Số e lớp ngoài cùng của nguyên tử các nguyên tố trong chu kỳ 2 tăng dần từ 1 đến 8
+ Đẩu chu kỳ 2 là một kim loại mạnh (Li), cuối chu kỳ là một phi kim mạnh (F), kết thúc chu kỳ là một khí hiếm (Ne).
2. Trong một nhóm
Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân.
- Số lớp electron của nguyên tử tăng dần.
- Tính kim loại của các nguyên tố tăng dần, đồng thời tính phi kim của các nguyên tố giảm dần.
Ví dụ: Nhóm IA gồm 6 nguyên tố từ Li đến Fr
+ Số lớp electron tăng dần từ 2 đến 7. Số electron lớp ngoài cùng của nguyên tử đều bằng 1.
+ Tính kim loại của các nguyên tố tăng dần. Đầu nhóm IA, Li là kim loại hoạt động hóa học mạnh cuối nhóm là kim loại Fr hoạt động hóa học rất mạnh
1. Biết vị trí của nguyên tố ta có thể suy đoán cấu tạo nguyên tử và tính chất của nguyên tố.
Ví dụ:
Biết: Nguyên tố A có số hiệu nguyên tử là 17, chu kì 3, nhóm VIIA.
Xác định được:
+ Nguyên tố A có số hiệu nguyên tử là 17, suy ra điện tích hạt nhân của nguyên tử A là 17+, nguyên tử A có 17 electron.
+ A ở chu kì 3, suy ra nguyên tử A có 3 lớp electron. Vì ở gần cuối chu kì 3 nên A là một phi kim mạnh, tính phi kim của A mạnh hơn của nguyên tố trước nó trong cùng chu kì (là S có số hiệu là 16).
+ A ở nhóm VIIA nên lớp ngoài cùng có 7 electron, tính phi kim của A yếu hơn của nguyên tố phía trên nó trong cùng nhóm (là F có số hiệu nguyên tử là 9) nhưng mạnh hơn nguyên tố đứng dưới nó trong cùng nhóm (là Br có số hiệu nguyên tử là 35).
2. Biết cấu tạo nguyên tử của nguyên tố có thể suy đoán vị trí và tính chất nguyên tố đó.
Ví dụ:
Biết: Nguyên tố X có điện tích hạt nhân là 11+, nguyên tử X có 3 lớp electron, lớp ngoài cùng có 1 electron.
Xác định được:
+ Nguyên tử X có điện tích hạt nhân là 11+ suy ra X ở ô 11
+ Nguyên tử X có 3 lớp electron nên X ở chu kỳ 3
+ Nguyên tử X có 1e ở lớp ngoài cùng nên X ở nhóm IA.
- Nguyên tố X là kim loại vì ở đầu chu kì
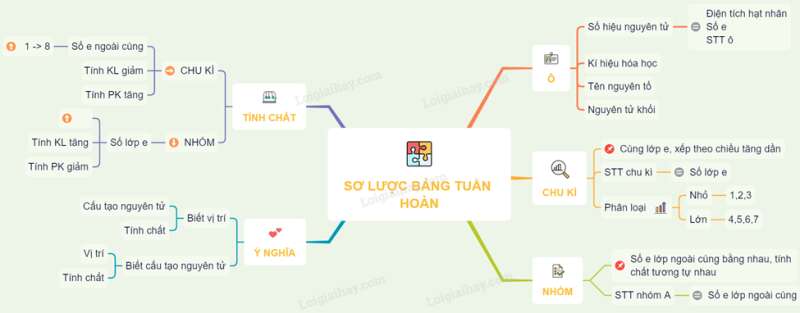
Sơ đồ tư duy: Sơ lược về bảng tuần hoàn các nguyên tố hoá học