Với giải Bài 2 trang 69 Hóa học lớp 10 Cánh diều chi tiết trong Bài 12: Liên kết Hydrogen và tương tác Van Der Waals giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 12: Liên kết Hydrogen và tương tác Van Der Waals
Bài 2 trang 69 Hóa học 10: Nhiệt độ nóng chảy và nhiệt độ sôi của hai chất HBr và HF như sau:
|
Chất |
Nhiệt độ nóng chảy (oC) |
Nhiệt độ sôi (oC) |
|
? |
–86,9 |
–66,8 |
|
? |
–83,6 |
19,5 |
Hãy gán công thức chất thích hợp vào các ô có dấu?
Phương pháp giải:
- So sánh nhiệt độ sôi, nhiệt độ nóng chảy của HBr và HF, nhiệt độ nóng chảy và nhiệt độ sôi của phân tử phụ thuộc vào 2 yếu tố:
+ Khối lượng phân tử: khối lượng càng lớn thì nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
+ Liên kết giữa các phân tử: số lượng liên kết giữa các phân tử càng nhiều lực liên kết càng mạnh khi đó cần nhiệt độ nóng chảy, nhiệt độ sôi cao đẻ phá vỡ liên kết của chúng.
- Điền công thức thích hợp vào ô có dấu ?
Lời giải:
- Mặc dù HBr có khối lượng phân tử lớn hơn so với HF, nhưng nhiệt độ nóng chảy và nhiệt độ của HBr thấp hơn so với HF.
Do trong phân tử HF có các liên kết hydrogen, còn HBr không có liên kết hydrogen. Để phá vỡ được các liên kết hydrogen liên phân tử trong HF cần phải cung cấp năng lượng để phá vỡ liên kết và động năng để phân tử chuyển động nhiều hơn so với phân tử HBr. Khi đó nhiệt độ nóng chảy, nhiệt độ sôi của HF đều lớn hơn HBr.
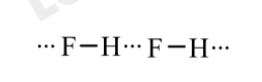
- Điền công thức thích hợp vào ô có dấu ?
|
Chất |
Nhiệt độ nóng chảy (oC) |
Nhiệt độ sôi (oC) |
|
HBr |
–86,9 |
–66,8 |
|
HF |
–83,6 |
19,5 |
Bài tập vận dụng:
Câu 1. Một loại liên kết rất yếu, hình thành bởi tương tác hút tĩnh điện giữa các cự trái dấu của phân tử là
A. tương tác van der waals
B. liên kết hydrogen
C. liên kết ion
D. liên kết cộng hóa trị
Đáp án: A
Giải thích: Tương tác van der waals là một loại liên kết rất yếu, hình thành bởi tương tác hút tĩnh điện giữa các cự trái dấu của phân tử.
Câu 2. Cho các phát biểu sau:
(1) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
(2) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hóa trị.
(3) Tương tác van der waals yếu hơn liên kết hydrogen.
(4) Tương tác van der waals mạnh hơn liên kết hydrogen.
Những phát biểu đúng là
A. (1) và (3)
B. (1) và (4)
C. (2) và (3)
D. (2) và (4)
Đáp án: A
Giải thích:
Những phát biểu đúng là
(1) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
(3) Tương tác van der waals yếu hơn liên kết hydrogen.
Câu 3. Liên kết hydrogen ảnh hưởng tới tính chất của nước như
A. đặc điểm tập hợp
B. nhiệt độ nóng chảy
C. nhiệt độ sôi
D. Cả A, B và C
Đáp án: D
Giải thích: Liên kết hydrogen ảnh hưởng tới tính chất của nước như: đặc điểm tập hợp, nhiệt độ nóng chảy và nhiệt độ sôi.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diều hay, chi tiết khác:
Vận dụng 4 trang 68 Hóa học 10: Sưu tầm hình ảnh tinh thể nước đá, bông tuyết....
Bài 1 trang 69 Hóa học 10: Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?...
Bài 3 trang 69 Hóa học 10: Chọn phương án đúng...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 12: Liên kết Hydrogen và tương tác Van Der Waals
Bài 13: Phản ứng oxi hóa - khử
Bài 14 : Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học