Với giải Câu hỏi 1 trang 65 Hóa học lớp 10 Cánh diều chi tiết trong Bài 12: Liên kết Hydrogen và tương tác Van Der Waals giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 12: Liên kết Hydrogen và tương tác Van Der Waals
Câu hỏi 1 trang 65 Hóa học 10: Vì sao nguyên tử H của của phân tử H2O không tạo được liên kết hydrogen với nguyên tử C của phân tử CH4?
Phương pháp giải:
Dựa vào khái niệm liên kết hydrogen: Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng. Các nguyên tố có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
Lời giải:
Nguyên tử H của H của của phân tử H2O không tạo được liên kết hydrogen với nguyên tử C của phân tử CH4. Vì nguyên tử C của phân tử CH4 không còn cặp electron riêng:
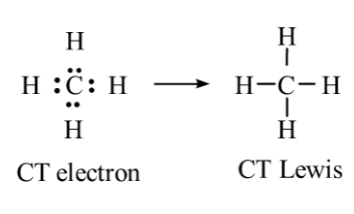
Lý thuyết Liên kết hydrogen
1. Khái niệm
- Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng.
- Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
- Liên kết hydrogen thường được kí hiệu là dấu ba chấm (...), rải đều từ nguyên tử H đến nguyên tử tạo liên kết hydrogen với nó.
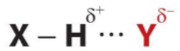
Trong đó, X, Y là các nguyên tử N, O, F
- Liên kết hydrogen có bản chất tĩnh điện. Tương tác hút tĩnh điện giữa và thể hiện bản chất của liên kết hydrogen.
Ví dụ 1: Liên kết hydrogen được tạo ra giữa hai phân tử nước được thể hiện qua hình 12.1.
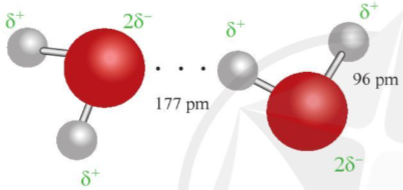
Hình 12.1. Liên kết hydrogen giữa hai phân tử nước
Ở khoảng cách 177 pm, lớn hơn độ dài liên kết cộng hóa trị O – H (96pm), đã xuất hiện liên kết hydrogen.
Lưu ý: Độ dài liên kết là khoảng cách giữa hai hạt nhân của hai nguyên tử tham gia liên kết.
2. Ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
a) Đặc điểm tập hợp
- Nhờ liên kết hydrogen, các phân tử nước có thể tập hợp với nhau, ngay cả ở thể hơi, thành một cụm phân tử tương đối bền vứng. Kích thước các cụm phân tử này thay đổi tùy theo điều kiện nhiệt độ, áp suất.
® Đây là nguyên nhân dẫn tới các tính chất vật lí khác biệt của nước so với những chất lỏng khác. Do đặc điểm tập hợp đặc biệt này, khi làm lạnh, nước có thể hình thành bông tuyết với nhiều hình dạng khác nhau.
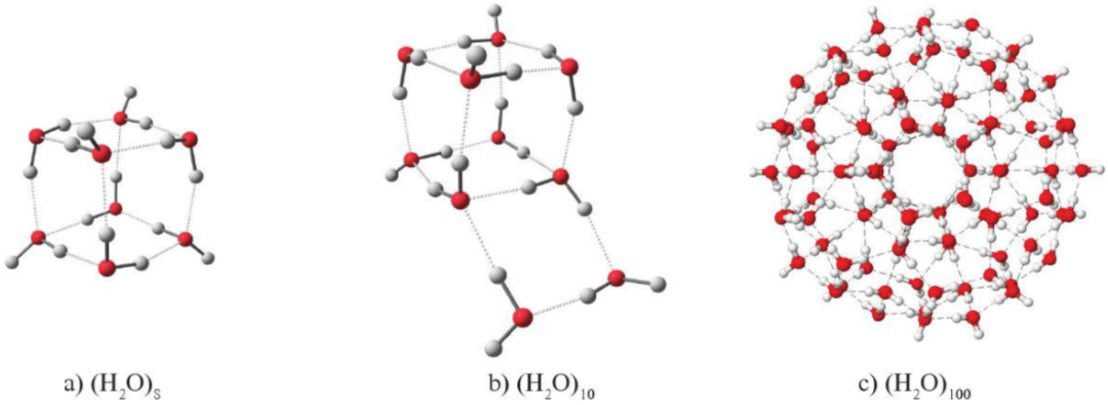
Hình 12.2. Một số cụm phân tử nước
b) Nhiệt độ nóng chảy và nhiệt độ sôi
- Tại áp suất 1atm, nước có nhiệt độ nóng chảy và nhiệt độ sôi tương ứng là 0oC và 100oC, cao hơn so với nhiều chất có khối lượng phân tử lớn hơn của nước. Tính chất này là do các phân tử nước liên kết khá chặt chẽ với nhau bởi các liên kết hydrogen.
Bảng 12.1. Nhiệt độ nóng chảy và nhiệt độ sôi của một số chất tại áp suất 1 atm
|
Chất |
Khối lượng phân tử (amu) |
Nhiệt độ nóng chảy (oC) |
Nhiệt độ sôi (oC) |
|
H2O |
18 |
0 |
100 |
|
H2S |
34 |
-82,3 |
-60,3 |
|
CO2 |
44 |
-57,0 |
-78,0 |
Chú ý: Để một chất có thể nóng chảy hoặc sôi, cần phải cung cấp năng lượng để phá vỡ các liên kết giữa các phân tử và cung cấp động năng để các phân tử chuyển động. Nhiệt độ nóng chảy và nhiệt độ sôi của chất phụ thuộc vào hai yếu tố:
(1) Khối lượng phân tử: Khối lượng phân tử càng lớn thì càng cần nhiều động năng để chuyển động nên nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
(2) Liên kết giữa các phân tử: Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì càng cần nhiều năng lượng để phá vỡ liên kết giữa chúng. Khi đó, nhiệt độ nóng chảy, nhiệt độ sôi của chất đó càng cao.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diều hay, chi tiết khác:
Vận dụng 4 trang 68 Hóa học 10: Sưu tầm hình ảnh tinh thể nước đá, bông tuyết....
Bài 1 trang 69 Hóa học 10: Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?...
Bài 2 trang 69 Hóa học 10: Nhiệt độ nóng chảy và nhiệt độ sôi của hai chất HBr và HF như sau:...
Bài 3 trang 69 Hóa học 10: Chọn phương án đúng...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 12: Liên kết Hydrogen và tương tác Van Der Waals
Bài 13: Phản ứng oxi hóa - khử
Bài 14 : Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học