Với giải Vận dụng 3 trang 67 Hóa học lớp 10 Cánh diều chi tiết trong Bài 12: Liên kết Hydrogen và tương tác Van Der Waals giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 12: Liên kết Hydrogen và tương tác Van Der Waals
Vận dụng 3 trang 67 Hóa học 10: Giải thích vì sao con tắc kè có thể di chuyển trên mặt kính trơn nhẵn, thẳng đứng.

Phương pháp giải:
- Tìm hiểu đặc điểm cấu tạo bàn chân của tắc kè.
- Dựa vào lý thuyết lực Van der Waals để giải thích: là một loại liên kết rất yếu, hình thành do lực hút tĩnh điện giữa các cực trái dấu của phân tử.
Lời giải:
- Bàn chân của tắc kè có rất nhiều sợi lông cực nhỏ, được gọi là sợi stetae có kích thước cỡ micromet. Ở đầu mỗi sợi lông lại phân nhánh thành rất nhiều sợi lông nhỏ dơn được gọi là spatulae với kích cỡ nanomet.
- Các sợi spatulae cho phép tắc kè bám được trên trường hay mặt phẳng nhờ tương tác tĩnh điện “hai điện tích trái dấu hút nhau”. Mỗi phân tử trong cơ thể sống hoặc một vật nào đó thường cân bằng về điện tích. Nhưng một mặt có xu hướng mang điện tích dương và mặt còn lại mang điện tích âm. Khi tắc kè leo tường, các sợi spatulae siêu nhỏ có thể quay mặt mang điện tích âm của chúng về phía mặt mang điện tích dương của phân tử trên bề mặt tường (và ngược lại), tạo ra lực hút giữa các phân tử được gọi là lực liên kết Van der Waals.
Lý thuyết Tương tác van der Waals
Giữa các phân tử thậm chí không có liên kết hydrogen thì vẫn có tương tác với nhau, mặc dù yếu hơn. Đó là tương tác van der Waals.
1. Khái niệm
- Tương tác van der Waals là một loại liên kết yếu, hình thành do tương tác hút tĩnh điện giữa các cực trái dấu của phân tử.
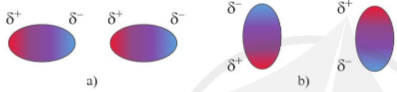
Hình 12.3. Các khả năng tương tác hút tĩnh điện giữa các cực trái dấu của hai phân tử
- Liên kết cộng hóa trị có cực là nguyên nhân dẫn tới sự phân cực ở các phân tử HCl, SO2, ...
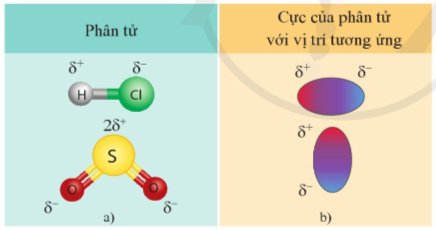
Hình 12.4. Một số phân tử có cực (a) và biểu diễn các cực của phân tử (b)
- Mặc dù có lực liên kết rất yếu, nhưng tương tác van der Waals lại có nhiều ảnh hưởng đến thực tiễn. Ví dụ: sự bám hút của các hạt bụi lên bề mặt nhẵn, sự hấp phụ các phân tử chất màu và chất độc hại trong nước bởi than hoạt tính, ...
Lưu ý: Phân tử CO2 không có cực, mặc dù liên kết C=O trong phân tử là liên kết có cực. Lí do bởi phân tử này có dạng thẳng, hai liên kết C=O lại có cực ngược chiều nhau nên triệt tiêu lẫn nhau khi xét cho cả phân tử
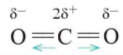
2. Ảnh hưởng của tương tác van der Waals tới tính chất vật lí của các chất
- Tương tự như liên kết hydrogen, tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất, nhưng ở mức độ ảnh hưởng yếu hơn so với liên kết hydrogen.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diều hay, chi tiết khác:
Vận dụng 4 trang 68 Hóa học 10: Sưu tầm hình ảnh tinh thể nước đá, bông tuyết....
Bài 1 trang 69 Hóa học 10: Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?...
Bài 2 trang 69 Hóa học 10: Nhiệt độ nóng chảy và nhiệt độ sôi của hai chất HBr và HF như sau:...
Bài 3 trang 69 Hóa học 10: Chọn phương án đúng...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 12: Liên kết Hydrogen và tương tác Van Der Waals
Bài 13: Phản ứng oxi hóa - khử
Bài 14 : Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học