Với giải Vận dụng 4 trang 68 Hóa học lớp 10 Cánh diều chi tiết trong Bài 12: Liên kết Hydrogen và tương tác Van Der Waals giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 12: Liên kết Hydrogen và tương tác Van Der Waals
Vận dụng 4 trang 68 Hóa học 10: Sưu tầm hình ảnh tinh thể nước đá, bông tuyết.
Phương pháp giải:
Tìm kiếm thông tin, hình ảnh bằng internet, sách báo khoa học…
Lời giải:
Sưu tầm hình ảnh tinh thể nước đá, bông tuyết:

Liên kết hydrogen trong nước giúp duy trì sự ổn định chất lỏng trong một phạm vi diện rộng, làm cho băng đá nhẹ hơn nước lỏng bởi vậy băng nổi trên mặt nước, nước có thể bay hơi làm cho hệ sinh thái trên Trái Đất tuần hoàn tự nhiên.
- Lực tương tác van der Waals: sự bám hút của hạt bụi trên bề măt; tắc kè, thạch sùng có thể bám chắc trên các bề mặt trơn nhẵn; khả năng kết dính của băng dính; sự hấp phụ chất độc và phân tử màu trong nước bởi than hoạt tính…
Lý thuyết Tương tác van der Waals
Giữa các phân tử thậm chí không có liên kết hydrogen thì vẫn có tương tác với nhau, mặc dù yếu hơn. Đó là tương tác van der Waals.
1. Khái niệm
- Tương tác van der Waals là một loại liên kết yếu, hình thành do tương tác hút tĩnh điện giữa các cực trái dấu của phân tử.
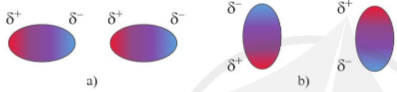
Hình 12.3. Các khả năng tương tác hút tĩnh điện giữa các cực trái dấu của hai phân tử
- Liên kết cộng hóa trị có cực là nguyên nhân dẫn tới sự phân cực ở các phân tử HCl, SO2, ...
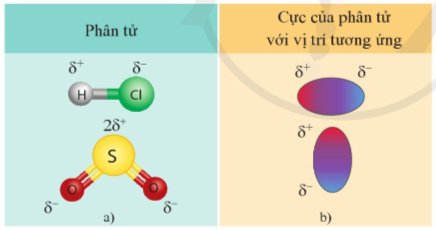
Hình 12.4. Một số phân tử có cực (a) và biểu diễn các cực của phân tử (b)
- Mặc dù có lực liên kết rất yếu, nhưng tương tác van der Waals lại có nhiều ảnh hưởng đến thực tiễn. Ví dụ: sự bám hút của các hạt bụi lên bề mặt nhẵn, sự hấp phụ các phân tử chất màu và chất độc hại trong nước bởi than hoạt tính, ...
Lưu ý: Phân tử CO2 không có cực, mặc dù liên kết C=O trong phân tử là liên kết có cực. Lí do bởi phân tử này có dạng thẳng, hai liên kết C=O lại có cực ngược chiều nhau nên triệt tiêu lẫn nhau khi xét cho cả phân tử
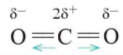
2. Ảnh hưởng của tương tác van der Waals tới tính chất vật lí của các chất
- Tương tự như liên kết hydrogen, tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất, nhưng ở mức độ ảnh hưởng yếu hơn so với liên kết hydrogen.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diều hay, chi tiết khác:
Bài 1 trang 69 Hóa học 10: Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?...
Bài 2 trang 69 Hóa học 10: Nhiệt độ nóng chảy và nhiệt độ sôi của hai chất HBr và HF như sau:...
Bài 3 trang 69 Hóa học 10: Chọn phương án đúng...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 12: Liên kết Hydrogen và tương tác Van Der Waals
Bài 13: Phản ứng oxi hóa - khử
Bài 14 : Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học