Với giải Luyện tập 4 trang 61 Hóa học lớp 10 Cánh diều chi tiết trong Bài 11: Liên kết cộng hóa trị giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 11: Liên kết cộng hóa trị
Luyện tập 4 trang 61 Hóa học 10: Viết ô orbital của lớp electron ngoài cùng cho nguyên tử H và F. Từ đó chỉ ra những AO nào có thể xen phủ tạo liên kết đơn trong các phân tử H2, F2 và HF.
Phương pháp giải:
Bước 1: Viết cấu hình electron và ô orbital của lớp electron ngoài cùng cho nguyên tử H, F.
Bước 2: Chỉ ra các AO có thể xen phủ tạo liên kết đơn trong các phân tử H2, F2, HF.
Liên kết đơn hay liên kết được tạo nên từ xen phủ trục của 2 AO, có 3 khả năng xen phủ trục: xen phủ giữa AO s với AO s; giữa AO s với AO p; giữa AO p với AO p.
Lời giải:
Bước 1: Viết cấu hình electron và ô orbital của lớp electron ngoài cùng cho nguyên tử H, F
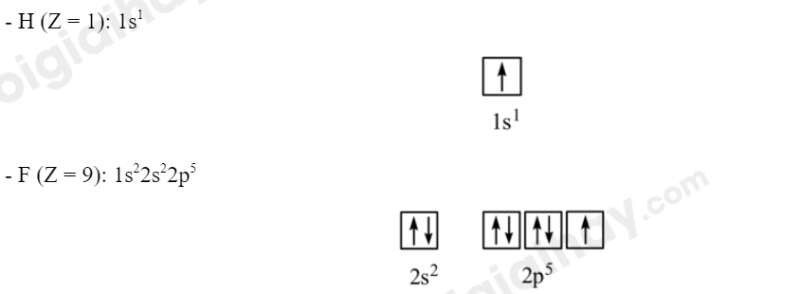
Bước 2: Chỉ ra các AO có thể xen phủ tạo liên kết đơn trong các phân tử H2, F2, HF.
- Trong phân tử H2: 2 AO s xen phủ trục tạo liên kết đơn.
- Trong phân tử F2: 2 AO p xen phủ trục tạo liên kết đơn.
- Trong phân tử HF: 1 AO s của H và 1 AO p của F xen phủ trục tạo liên kết đơn
Lý thuyết Liên kết sigma (s) và liên lết pi (p)
- Liên kết cộng hóa trị được hình thành từ cặp electron dùng chung. Để tạo nên một cặp electron dùng chung, hai AO chứa electron độc thân (hoặc giữa một AO trống và 1 AO bão hòa electron) cần xen phủ với nhau.
- Có hai kiểu xen phủ AO là xen phủ trục và xen phủ bên.
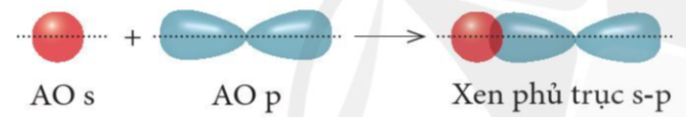
- Xen phủ trục: là xen phủ giữa hai AO dọc theo trục nối (trục z) hai nguyên tử. Có ba khả năng xen phủ trục.
+ Xen phủ giữa AO s với AO s

+ Xen phủ giữa AO s với AO p
+ Xen phủ giữa AO p với AO p
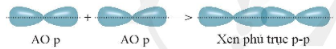
Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma (s).
- Xen phủ bên: là sự xen phủ xảy ra giữa hai AO p song song với nhau.
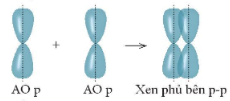
Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi (p).
- Kết luận: Liên kết đơn còn gọi là liên kết s, liên kết đôi gồm một liên kết s và một liên kết p, liên kết ba gồm một liên kết s và hai liên kết p.
Lưu ý:
- Khi các nguyên tử liên kết với nhau, các AO phải được sắp xếp ở vị trí phù hợp. Chẳng hạn khi hình thành phân tử hai nguyên tử, vị trí của các AO như sau:
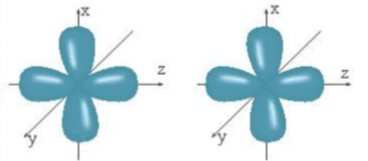
+ Hai AO pz nằm dọc trên cùng một trục nên chỉ có thể xen phủ trục với nhau.
+ Hai AO px (cũng như hai AO py) là song song với nhau nên chỉ có thể xen phủ bên với nhau.
- Liên kết s bền vững hơn liên kết p bởi vùng xen phủ AO chứa electron chung chắn giữa hai hạt nhân, làm giảm lực đẩy giữa chúng. Để phân tử bền vững thì trong phân tử phải luôn có liên kết s.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diều hay, chi tiết khác:
Câu hỏi 6 trang 59 Hóa học 10: Những nguyên tử nào trong cation ammonium thỏa mãn quy tắc octet?...
Luyện tập 2 trang 59 Hóa học 10: Trình bày sự hình thành ion hydronium (H3O+) từ H2O và H+
Vận dụng 1 trang 62 Hóa học 10: Xây dựng mô hình phân tử....
Bài 1 trang 63 Hóa học 10: Những phát biểu nào sau đây đúng?...
Bài 2 trang 63 Hóa học 10: Những phát biểu nào sau đây đúng?...
Bài 4 trang 63 Hóa học 10: Sử dụng bảng giá trị năng lượng liên kết ở Phụ lục 2....
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 12: Liên kết Hydrogen và tương tác Van Der Waals
Bài 13: Phản ứng oxi hóa - khử
Bài 14 : Phản ứng hóa học và enthalpy