Với giải Câu hỏi 2 trang 58 Hóa học lớp 10 Cánh diều chi tiết trong Bài 11: Liên kết cộng hóa trị giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 11: Liên kết cộng hóa trị
Câu hỏi 2 trang 58 Hóa học 10: Trong phân tử HCl, lớp electron ngoài cùng của Cl và H lần lượt có bao nhiêu electron?
Phương pháp giải:
Dựa vào cấu hình electron lớp ngoài cùng của Cl và H ⟹ Tính số electron.
Lời giải:
- Cấu hình electron của H: 1s1 ⟹ Có 1 electron ở lớp ngoài cùng.
- Cấu hình electron của Cl: [Ne]3s23p5 ⟹ Có 7 electron ở lớp ngoài cùng.
Lý thuyết Liên kết cộng hóa trị
- Quy tắc octet có thể đạt được bằng cách góp chung electron.
- Electron dùng chung là electron được coi như thuộc về đồng thời hai nguyên tử tham gia liên kết.
- Liên kết cộng hóa trị là liên kết được hình thành bởi một hay nhiều cặp electron dùng chung giữa hai nguyên tử.
- Liên kết cộng hóa trị thường gặp giữa phi kim với phi kim.
Ví dụ 1: Nguyên từ hydrogen (H) có cấu hình electron là 1s1, chlorine (Cl) có cấu hình electron là [Ne]3s23p5. Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử H và Cl cùng góp 1 electron để tạo nên 1 cặp electron dùng chung cho cả hai nguyên tử.
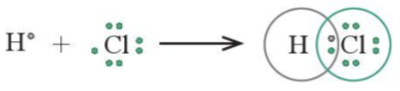 Hình 11.1. Sơ đồ mô tả sự hình thành cặp electron dùng chung của HCl
Hình 11.1. Sơ đồ mô tả sự hình thành cặp electron dùng chung của HCl
+ Như vậy, liên kết giữa nguyên tử H và Cl được tạo nên bởi 1 cặp electron dùng chung. Công thức ![]() được gọi là công thức electron của HCl.
được gọi là công thức electron của HCl.
+ Nếu giữa hai nguyên tử chỉ có một cặp electron dùng chung thì cặp electron này được biểu diễn bằng một nối đơn (-) và được gọi là liên kết đơn. Khi đó HCl được biểu diễn như sau:
![]()
+ Công thức trên được gọi là công thức Lewis của HCl.
+ Hợp chất HCl được tạo nên bởi liên kết cộng hóa trị nên thuộc loại hợp chất cộng hóa trị.
- Kết luận: Công thức Lewis biểu diễn cấu tạo phân tử qua các liên kết (cặp electron dùng chung) và các electron hóa trị riêng.
- Chú ý:
+ Nếu giữa hai nguyên tử có hai cặp electron dùng chung thì hai cặp electron này được biểu diễn bằng một nối đôi (=) và gọi là liên kết đôi.
+ Nếu giữa hai nguyên tử có ba cặp electron dùng chung thì ba cặp electron này được biểu diễn bằng một nối ba (≡) và gọi là liên kết ba.
Ví dụ 2: Phân tử ammonia kết hợp với ion H+ tạo ra cation ammonium ()
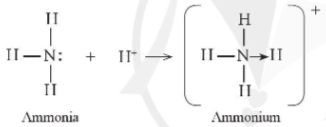
Hình 11.4. Sơ đồ mô tả sự hình thành liên kết cho – nhận trong cation ammonium
+ Trên nguyên tử N còn một cặp electron hóa trị riêng, khi hình thành ion , cặp electron này trở thành cặp electron dùng chung cho cả N và H, cả N và các nguyên tử H đều thỏa mãn quy tắc octet.
+ Như vậy, liên kết đơn giữa nguyên tử N trong NH3 với H+ được tạo thành bởi một cặp electron góp chung của nguyên tử N.
+ Để chỉ rõ sự khác biệt về nguồn gốc cặp electron dùng chung, liên kết tạo bởi cặp electron của N và ion H+ được kí hiệu là mũi tên (®) xuất phát từ N. Loại liên kết này được gọi là liên kết cho – nhận.
- Kết luận: Liên kết cho – nhận là liên kết cộng hóa trị mà cặp electron dùng chung được đóng góp từ một nguyên tử.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diều hay, chi tiết khác:
Câu hỏi 6 trang 59 Hóa học 10: Những nguyên tử nào trong cation ammonium thỏa mãn quy tắc octet?...
Luyện tập 2 trang 59 Hóa học 10: Trình bày sự hình thành ion hydronium (H3O+) từ H2O và H+
Vận dụng 1 trang 62 Hóa học 10: Xây dựng mô hình phân tử....
Bài 1 trang 63 Hóa học 10: Những phát biểu nào sau đây đúng?...
Bài 2 trang 63 Hóa học 10: Những phát biểu nào sau đây đúng?...
Bài 4 trang 63 Hóa học 10: Sử dụng bảng giá trị năng lượng liên kết ở Phụ lục 2....
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 12: Liên kết Hydrogen và tương tác Van Der Waals
Bài 13: Phản ứng oxi hóa - khử
Bài 14 : Phản ứng hóa học và enthalpy