Tailieumoi.vn xin giới thiệu phương trình 2NaOH + SO2 → Na2SO3 + H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Natri. Mời các bạn đón xem:
Phương trình 2NaOH + SO2 → Na2SO3 + H2O
1. Phương trình phản ứng hóa học:
2NaOH + SO2 → Na2SO3 + H2O
2. Hiện tượng nhận biết phản ứng
- Quan sát sự chuyển màu của chỉ thị phù hợp trước và sau phản ứng.
3. Điều kiện phản ứng
- Phản ứng xảy ra ngay điều kiện thường.
4. Tính chất hóa học
4.1. TÍnh chất hóa học của NaOH
NaOH Là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
Tác dụng với một số phi kim như Si, C, P, S, Halogen
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
Cl2+ 2NaOH → NaCl + NaClO + H2O
4.2. Tính chất hóa học của SO2
Lưu huỳnh đioxit mang đầy đủ tính chất hóa học của một oxit axit.
- Tác dụng với nước tạo thành dung dịch axit.
SO2 + H2O → H2SO3
- Tác dụng với dung dịch bazơ tạo thành muối và nước.
SO2 + 2NaOH → Na2SO3 + H2O
- Tác dụng với oxit bazơ tạo thành muối.
SO2 + Na2O → Na2SO3
5. Cách thực hiện phản ứng
- Dẫn khí SO2 vào ống nghiệm chứa NaOH và vài giọt chất chỉ thị.
6. Bạn có biết
- NaOH phản ứng với SO2 tùy theo tỉ lệ về số mol mà sản phẩm thu được có thể là muối sunfit trung hòa hoặc muối axit hoặc hỗn hợp cả hai muối.
- NaOH phản ứng với SO2 chỉ thu được muối Na2SO3 khi T = 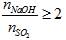
7. Bài tập liên quan
Ví dụ 1: Cho 2,24 lít khí SO2 ở đktc phản ứng với lượng dư dung dịch NaOH thu được dung dịch X. Khối lượng muối tan có trong X là
A. 12,6 gam.
B. 13,8 gam.
C. 11,8 gam.
D. 10,8 gam.
Hướng dẫn giải
Do NaOH dư nên có phản ứng
Đáp án A.
Ví dụ 2: Cho SO2 tác dụng với lượng dư dung dịch NaOH thu được dung dịch X. Chất tan có trong dung dịch X là
A. Na2SO3.
B. Na2SO3 và NaHSO3.
C. NaHSO3.
D. Na2SO3 và NaOH.
Hướng dẫn giải
Do NaOH dư nên có phản ứng
2NaOH + SO2 → Na2SO3 + H2O
Chất tan có trong dung dịch X là Na2SO3 và NaOH dư.
Đáp án D.
Ví dụ 3: Cho 2,24 lít khí SO2 ở đktc phản ứng với dung dịch chứa 0,3 mol NaOH. Khối lượng muối tan có trong dung dịch sau phản ứng là
A. 12,6 gam.
B. 13,6 gam.
C. 11,8 gam.
D. 10,6 gam.
Hướng dẫn giải
Có T = 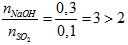
Đáp án A.
Ví dụ 4. Khi điều chế Na, người ta điện phân nóng chảy NaCl với anot làm bằng:
A. thép
B. nhôm.
C. than chì.
D. magie.
Hướng dẫn giải
Đáp án C
Ví dụ 5. Cho các phát biểu sau về ứng dụng của kim loại kiềm :
(1) Kim loại kiềm dùng để chế tạo hợp kim có nhiệt độ nóng chảy thấp,
(2) Kim loại kiềm dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt kim loại.
(3) Kim loại kiềm dùng đề làm xúc tác trong nhiều phản ứng hữu cơ.
(4) Kim loai kiềm dùng để làm điện cực trong pin điện hóa
(5) Kim loại kiềm dùng để gia công các chi tiết chịu mài mòn trong máy bay, tên lửa, ô tô
Trong các phát biểu trên, số phát biểu đúng là:
A. 1.
B. 2.
C. 3.
D. 4
Hướng dẫn giải
Ứng dụng của kim loại kiềm :
(1) Kim loại kiềm dùng để chế tạo hợp kim có nhiệt độ nóng chảy thấp,
(2) Kim loại kiềm dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt kim loại.
(3) Kim loại kiềm dùng đề làm xúc tác trong nhiều phản ứng hữu cơ.
Đáp án C
Ví dụ 6. Cho 3,36 gam hỗn hợp gồm K và một kim loại kiềm A vào nước thấy thoát ra 1,792 lít H2. Thành phần phần trăm về khối lượng của A là
A. 18,75 %.
B. 10,09%.
C. 13,13%.
D. 55,33%.
Hướng dẫn giải
Gọi công thức chung của 2 kim loại kiềm là M
Phương trình phản ứng tổng quát là
M + H2O → MOH + 1/2H2
nM= 2nH2 = 0,16 mol → M = 21
=> Li (7) < M = 21 < K (39)
Gọi số mol của K và Li lần lượt là x và y:
Ta có hệ phương trình phản ứng sau
39x + 7y = 3,36
x + y=0,16
→ x = 0,07, y = 0,09
%mLi= (0,09.73,36).100% = 18,75%
Đáp án A
Ví dụ 7. Đặt một mẩu nhỏ natri lên một tờ giấy thấm gấp thành dạng thuyền. Đặt chiếc thuyền giấy này lên một chậu nước có nhỏ sẵn vài giọt phenolphtalein.
Dự đoán hiện tượng có thể quan sát được ở thí nghiệm như sau :
(a) Chiếc thuyền chạy vòng quanh chậu nước.
(b) Thuyền bốc cháy.
(c) Nước chuyển màu hồng.
(d) Mẩu natri nóng chảy.
Trong các dự đoán trên, số dự đoán đúng là:
A. 1.
B. 2.
C. 3.
D. 4.
Hướng dẫn giải
Đáp án D
Ví dụ 8: Phát biểu nào sau đây là sai khi nói về 2 muối NaHCO3 và Na2CO3?
A. Cả 2 muối đều dễ bị nhiệt phân.
B. Cả 2 muối đều tác dụng với axit mạnh giải phóng khí CO2.
C. Cả 2 muối đều bị thủy phân tạo mỗi trường kiềm yếu.
D. Cả 2 muối đều có thể tác dụng với dung dịch Ca(OH)2 tạo kết tủa.
Hướng dẫn giải
Phát biểu A sai vì Na2CO3 không bị nhiệt phân
Đáp án A
Ví dụ 9. Nhận xét nào sau đây không đúng về SO2?
A. khí này làm mất màu dung dịch nước brom và dung dịch thuốc tím.
B. Phản ứng được với H2S tạo ra S.
C. Liên kết trong phân tử là liên kết cộng hóa trị có cực
D. Được tạo ra khi sục khí O2 vào dung dịch H2S.
Hướng dẫn giải
A. Đúng .
B. Đúng.
C. Đúng. SO2 có liên kết cộng hóa trị phân cực và liên kết cho nhận.
D. Sai.Không thể tạo SO2 khi sục khí O2 vào dung dịch H2S.
Đáp án D
Ví dụ 10. Hãy chỉ ra câu trả lời sai về SO2
A. SO2 làm đỏ quỳ tím
B. SO2 làm mất màu dung dịch Br2
C. SO2 là chất khí, màu vàng
D. SO2 làm mất màu cánh hoa hồng
Hướng dẫn giải
SO2 là khí không màu chứ không phải màu vàng
SO2 tác dụng với nước trong quỳ tím ẩm tạo H2SO3 làm quỳ tím đổi màu
SO2 có tính khử nên làm mất màu nước brom và cánh hoa hồng
Đáp án C
Ví dụ 11. Phát biểu nào sau đây sai?
A. Ở nhiệt độ thường, H2S là chất khí không màu, có mùi trứng thối, rất độc.
B. Ở nhiệt độ thường, SO2 là chất khí không màu, mùi hắc, tan nhiều trong nước.
C. Ở nhiệt độ thường, SO3 là chất khí không màu, tan vô hạn trong nước.
D. Trong công nghiệp, SO3 là chất khí không màu, tan vô hạn trong nước.
Hướng dẫn giải
Đáp án C
Ví dụ 12. Cho các phát biểu sau:
(a) Sục khí SO2 vào dung dịch NaOH dư tạo ra muối trung hòa Na2SO3.
b) SO2 vừa có tính khử, vừa có tính oxi hóa.
(c) Khí SO2 là một trong những nguyên nhân chính gây ra mưa axit.
(d) Khí SO2 có màu vàng lục và rất độc.
Số phát biểu đúng là:
A. 3
B. 1
C. 4
D. 2
Hướng dẫn giải
Phát biểu đúng là a, b, c
d sai vì SO2 không màu
Đáp án A
Ví dụ 13. Chỉ ra câu trả lời không đúng về khả năng phản ứng của S?
A. S vừa có tính oxi hoá vừa có tính khử.
B. Hg phản ứng với S ngay nhiệt độ thường.
C. Ở nhiệt độ thích hợp, S tác dụng với hầu hết các phi kim và thể hiện tính oxi hóa.
D. Ở nhiệt độ cao, S tác dụng với nhiều kim loại và thể hiện tính oxi hoá.
Hướng dẫn giải
Câu không đúng là: Ở nhiệt độ thích hợp, S tác dụng với hầu hết các phi kim và thể hiện tính oxi hóa.
Vì S phản ứng với oxi thể hiện tính khử: S + O2 → SO2
Đáp án C
8. Một số phương trình phản ứng hóa học khác của Natri và hợp chất:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓
3NaOH + FeCl3 → 3NaCl + Fe(OH)3↓