Tailieumoi.vn xin giới thiệu phương trình NaOH + SO2 → NaHSO3 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Natri. Mời các bạn đón xem:
Phương trình NaOH + SO2 → NaHSO3
1. Phương trình phản ứng hóa học:
NaOH + SO2 → NaHSO3
2. Hiện tượng nhận biết phản ứng
- Quan sát sự chuyển màu của chỉ thị phù hợp trước và sau phản ứng.
3. Điều kiện phản ứng
- Phản ứng xảy ra ngay điều kiện thường.
4. Tính chất hóa học
4.1. Tính chất hóa học của NaOH
NaOH Là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
4.2. Tính chất vật lí của SO2
- Là không màu, mùi hắc, nặng hơn không khí (d = )
- Tan nhiều trong nước (ở 20oC, một thể tích nước có thể hòa tan được 40 thể tích SO2).
- Hóa lỏng ở -10oC.
- Là khí độc, hít thở phải không khí có khí này sẽ gây viêm đường hô hấp.
4.3. Tính chất hóa học của SO2
Lưu huỳnh đioxit mang đầy đủ tính chất hóa học của một oxit axit.
- Tác dụng với nước tạo thành dung dịch axit.
SO2 + H2O → H2SO3
- Tác dụng với dung dịch bazơ tạo thành muối và nước.
SO2 + 2NaOH → Na2SO3 + H2O
- Tác dụng với oxit bazơ tạo thành muối.
SO2 + Na2O → Na2SO3
- Vừa là chất oxy hóa, vừa là chất khử
- Chất khử: phản ứng với chất oxy hóa mạnh
2SO2 + O2 → 2SO3 (V2O5, 450 oC)
Cl2 +SO2 + 2H2O → H2SO4 + 2HCl
- Làm mất màu nước Brom
SO2 + Br2 + 2H2O → 2HBr + H2SO4
- Làm mất màu dung dịch thuốc tím
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
- Chất oxy hoá mạnh: tác dụng với chất khử mạnh
SO2 + 2H2S → 3S + 2H2O
SO2 + 2Mg → S + 2MgO
4.4. Ứng dụng và điều chế lưu huỳnh đioxit
a. Ứng dụng
- Sản xuất axit sunfuric trong công nghiệp
- Tấy trắng giấy, bột giấy.
- Chống nấm mốc cho lương thực, thực phẩm …
b. Điều chế
- Trong phòng thí nghiệm:Đun nóng dd H2SO4 với muối Na2SO3, sau đó thu SO2 bằng cách đẩy không khí. Phương trình hóa học:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
- Trong công nghiệp
Đốt cháy S hoặc đốt cháy quặng pirit sắt:
4FeS2 + 11O2 2Fe2O3 + 8SO2
5. Cách thực hiện phản ứng
- Dẫn khí SO2 từ từ đến dư vào ống nghiệm chứa NaOH và vài giọt chất chỉ thị.
6. Bạn có biết
- NaOH phản ứng với SO2 tùy theo tỉ lệ về số mol mà sản phẩm thu được có thể là muối sunfit trung hòa hoặc muối axit hoặc hỗn hợp cả hai muối.
- NaOH phản ứng với SO2 chỉ thu được muối NaHSO3 khi T = 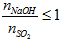
7. Bài tập liên quan
Ví dụ 1: Cho 0,1 mol NaOH phản ứng với lượng dư SO2 ở đktc thu được dung dịch X. Khối lượng muối tan có trong X là
A. 13,8 gam.
B. 12,8 gam.
C. 10,4 gam.
D. 12,0 gam.
Hướng dẫn giải
Do SO2 dư nên có phản ứng
Đáp án C.
Ví dụ 2: Dẫn khí SO2 từ từ đến dư vào dung dịch NaOH thu được dung dịch X. Muối tan có trong dung dịch X là
A. Na2SO3.
B. Na2SO3 và NaHSO3.
C. NaHSO3.
D. Na2SO3 và NaOH.
Hướng dẫn giải
Do SO2 dư nên có phản ứng NaOH + SO2 → NaHSO3
Muối tan có trong dung dịch X là NaHSO3.
Đáp án C.
Ví dụ 3: Cho 2,24 lít khí SO2 ở đktc phản ứng với dung dịch chứa 0,05 mol NaOH. Khối lượng muối tan có trong dung dịch sau phản ứng là
A. 5,2 gam.
B. 12,8 gam.
C. 10 gam.
D. 5 gam.
Hướng dẫn giải
Có T = 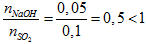
Đáp án A.
Ví dụ 4: Cho V lít SO2 (đktc) tác dụng hết với dung dịch Br2 dư. Thêm tiếp vào dung dịch sau phản ứng BaCl2 dư thu được 2,33 gam kết tủa. Thể tích V là:
A. 0,112 lít
B. 1,12 lít
C. 0,224 lít
D. 2,24 lít
Hướng dẫn giải:
Đáp án C
Ví dụ 5: Sục một lượng khí SO2 vào dung dịch Ba(OH)2, thu được dung dịch B kết tủa C. Đun nóng dung dịch B lại thấy xuất hiện kết tủa. Dung dịch B tác dụng với Ba(OH)2 sinh ra được kết tủa. Thành phần của dung dịch B là:
A. BaSO3 và Ba(OH)2 dư
B. Ba(HSO3)2
C. Ba(OH)2
D. BaHSO3 và Ba(HSO3)2
Hướng dẫn giải:
Đáp án B
SO2 + Ba(OH)2 → BaSO3 ↓ + H2O
2SO2 + Ba(OH)2 → Ba(HSO3)2
Ba(HSO3)2 BaSO3↓ + SO2 + H2O
Ba(HSO3)2 + Ba(OH)2 → 2BaSO3↓ + 2H2O
Ví dụ 6: Cho sơ đồ phản ứng hóa học: H2S + O2 (dư) X + H2O. Chất X có thể là
A. SO2
B. S
C. SO3
D. S hoặc SO2
Hướng dẫn giải:
Đáp án A
Do O2 dư nên X là SO2, phương trình hóa học:
H2S + 3O2 (dư) 2SO2 + 2H2O
8. Một số phương trình phản ứng hóa học khác của Natri và hợp chất:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓
3NaOH + FeCl3 → 3NaCl + Fe(OH)3↓
2NaOH + Mg(NO3)2 → 2NaNO3 + Mg(OH)2↓