Với giải Câu hỏi 1 trang 68 Hóa học lớp 10 Chân trời sáng tạo chi tiết tron Bài 11: Liên kết hydrogen và tương tác van der waals giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 11: Liên kết hydrogen và tương tác van der waals
Câu hỏi 1 trang 68 Hóa học 10: Giữa liên kết S-H và liên kết O-H, liên kết nào phân cực mạnh hơn? Vì sao?
Phương pháp giải:
Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung
Lời giải:
Nguyên tử bị thiếu bao nhiêu electron thì bỏ ra bấy nhiêu electron để góp chung electron với các nguyên tử khác => Đạt cấu hình eleectron bền vững của khí hiếm
Ví dụ:
- Xét liên kết O – H:
∆χ = 3,44 – 2,2 = 1,24 ⇒ Liên kết O-H là liên kết cộng hóa trị phân cực.
- Xét liên kết S – H:
∆χ = 2,58 – 2,2 = 0,38 ⇒ Liên kết S-H là liên kết cộng hóa trị không phân cực.
Vậy liên kết O-H phân cực mạnh hơn.
Lý thuyết Liên kết hydrogen
1. Tìm hiểu về liên kết hydrogen
- Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết.
- Liên kết hydrogen thường được biểu diễn bằng dấu ba chấm (…).
- Ví dụ: Liên kết hydrogen giữa các phân tử nước:
+ Trong phân tử nước nguyên tử O có độ âm điện lớn và còn hai cặp electron chưa tham gia liên kết.
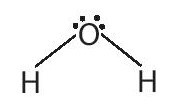
+ Lực hút tĩnh điện giữa nguyên tử H mang một phần điện tích dương (linh động) của phân tử H2O này với nguyên tử oxygen mang một phần điện tích âm của phân tử H2O khác, tạo thành liên kết hydrogen giữa các phân tử nước.
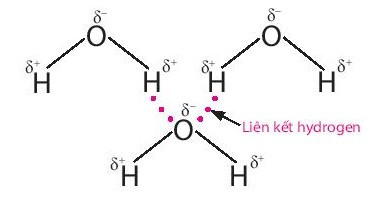
Chú ý:
Thứ tự tăng dần độ bền liên kết: Liên kết hydrogen < liên kết cộng hóa trị < liên kết ion.
2. Vai trò, ảnh hưởng của liên kết hydrogen tới tính chất vật lý của nước
- So với các hợp chất có cấu trúc tương tự, các hợp chất có liên kết hydrogen đều có nhiệt độ sôi cao hơn do tạo được liên kết hydrogen liên phân tử và tan tốt hơn trong nước do tạo được liên kết hydrogen với các phân tử nước.
- Nước là một hợp chất có nhiệt độ nóng chảy và nhiệt độ sôi cao hơn nhiều so với hợp chất có cùng cấu trúc phân tử nhưng không tạo được liên kết hydrogen giữa các phân tử với nhau.
- Ngoài ra, nước còn là một dung môi tốt, không chỉ hòa tan được nhiều hợp chất ion mà còn hòa tan được nhiều hợp chất có liên kết cộng hóa trị phân cực. Đặc biệt các hợp chất có thể tạo liên kết hydrogen với nước thường tan tốt trong nước.
Ví dụ: Ammonia tan tốt trong nước do tạo được liên kết hydrogen với nước
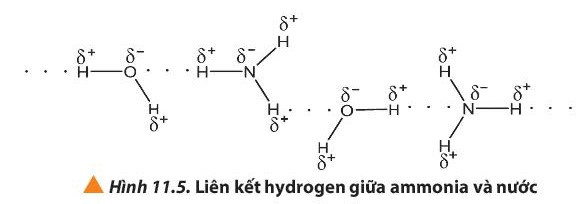
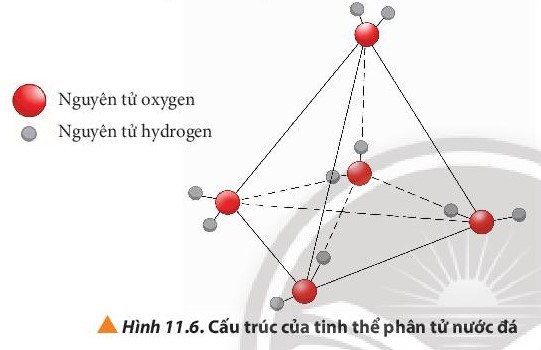
- Nước ở trạng thái rắn có thể tích lớn hơn khi ở trạng thái lỏng. Đó là do nước đá có cấu trúc tinh thể phân tử với 4 phân tử H2O phân bố ở 4 đỉnh của hình tứ diện đều, bên trong là cấu trúc rỗng. Điều này giải thích tại sao nước đá nổi lên trên nước lỏng.
Xem thêm lời giải bài tập Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 1 trang 71 Hóa học 10: Hợp chất nào dưới đây được liên kết hydrogen liên phân tử...
Bài 3 trang 71 Hóa học 10: Khí hiếm nào dưới đây có nhiệt độ sôi thấp nhất?...
Bài 4 trang 71 Hóa học 10: Biểu diễn liên kết hydrogen giữa các phân tử:...
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der waals
Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học