Với giải Bài 3 trang 54 Hóa học lớp 10 Chân trời sáng tạo chi tiết trong Bài 8: Quy tắc octet giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 8: Quy tắc octet
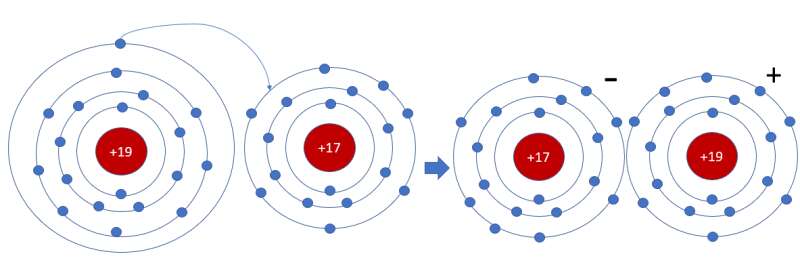
Bài 3 trang 54 Hóa học 10: Vận dụng quy tắc octet, trình bày sơ đồ mô tả sự hình thành phân tử potassium chloride (KCl) từ nguyên tử của các nguyên tố potassium và chlorine.
Phương pháp giải:
Bước 1: Viết cấu hình electron của nguyên tử K và Cl => Xu hướng nhường hay nhận electron của K và Cl
Bước 2: Vẽ sơ đồ mô tả
Lời giải:
- Nguyên tử K (Z = 19): 1s22s22p63s23p64s1 => Có xu hướng nhường 1 electron
- Nguyên tử Cl (Z = 17): 1s22s22p63s23p5 => Có xu hướng nhận 1 electron
=> Nguyên tử Cl sẽ nhận 1 electron của nguyên tử K để hình thành phân tử potassium chlorine (KCl)
- Sơ đồ mô tả:
Bài tập vận dụng:
Câu 1. Để đạt được quy tắc octet, nguyên tử potassium (Z= 19) phải nhường đi
A. 2 electron
B. 1 electron
C. 3 electron
D. 4 electron
Đáp án đúng là: B
potassium (Z= 19) có cấu hình electron là: 1s22s22p63s23p64s1
⇒ Có 1 electron lớp ngoài cùng.
Khí hiếm gần nhất là: Ar (Z = 18): 1s22s22p63s23p6
Do đó, nguyên tử potassium phải nhường đi 1 electron để đạt được cấu hình electron bền vững với 8 electron lớp ngoài cùng theo quy tắc octet.
Câu 2. Để đạt được quy tắc octet, nguyên tử nitrogen (Z= 7) phải nhận thêm
A. 2 electron
B. 1 electron
C. 3 electron
D. 4 electron
Đáp án đúng là: C
Nitrogen (Z= 7) có cấu hình electron là: 1s22s22p3
⇒ Có 5 electron lớp ngoài cùng.
Khí hiếm gần nhất là: Ne (Z = 10): 1s22s22p6
Do đó, nguyên tử nitrogen phải nhận thêm 3 electron để đạt được cấu hình electron bền vững với 8 electron lớp ngoài cùng theo quy tắc octet.
Câu 3. Ion lithium có cấu hình electron của khí hiếm tương ứng nào
A. He
B. Ne
C. Ar
D. Kr
Đáp án đúng là: A
Lithium (Z = 3): 1s22s1 ⇒ Có 1 electron lớp ngoài cùng.
Khí hiếm gần nhất là: He (Z = 2): 1s2
Do đó, nguyên tử Li có xu hướng nhường 1 electron để đạt được cấu hình electron bền vững.
Li ⟶ Li+ + 1e
1s22s11s2
Vậy ion lithium có cấu hình electron của khí hiếm He.
Xem thêm lời giải bài tập Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học